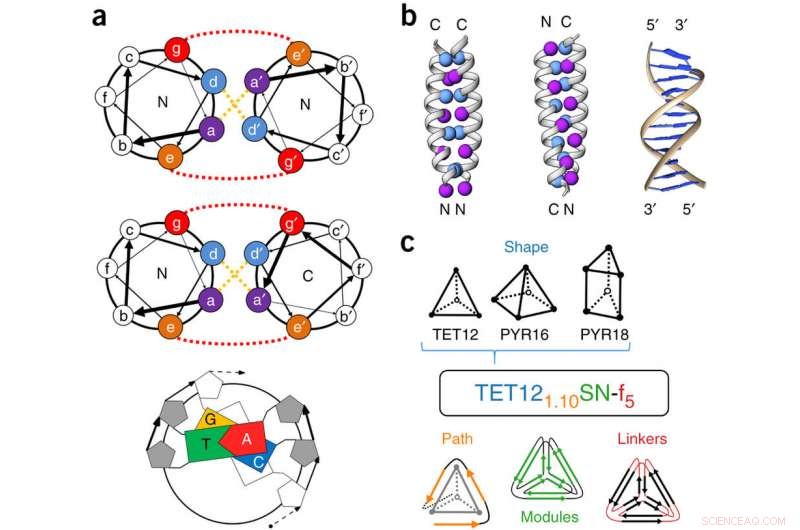
CC-modulstruktur och CCPO-nomenklatur. (a) Coiled-coils (CC) definieras av en regelbunden upprepande enhet med sju aminosyrarester, märkt a, b, c, d, e, f, eller g (en heptad upprepning). Interaktionsspecificitet kodas av hydrofoba interaktioner vid positionerna a och d (gula streckade linjer) och elektrostatiska interaktioner mellan positionerna e och g (röda streckade linjer). DNA-komplementaritetsregler är jämförelsevis enkla, eftersom endast fyra byggnadselement är närvarande. (b) CC-dimerer kan paras ihop i en parallell eller antiparallell orientering. Positionerna a och d visas som sfärer. B-strängs-DNA kan bara paras i en antiparallell orientering. (c) Ett exempelnamn (TET12 1.10 SN-f 5 ) visas i mitten av panelen. De fullständiga namnen på polyedrarna definieras av typen av polyeder (TET =tetrahedron; PYR =pyramid; TRIP =trigonalt prisma) följt av antalet CC-segment (visas i blått). Underskriften (i orange) betecknar topologin och cirkulär permutation av varje polyhedron, dvs. den dubbla Euleriska vägen som polypeptidkedjan gör över polyedern. Nästa etikett (grön) anger typen av CC-moduler som används (S =soluble; SN =soluble, negativt laddad), länktyp (f =flexibel; c =laddad), och, i prenumerationsform (röd), länkens längd. I fall där två varianter har samma namn (t.ex. olika beställningar av CC -moduler), bokstäverna b, c, d, och så vidare bifogas. De mest omfattande karakteriserade polyedrarna hänvisas till med kortare namn:TET12SN (TET12 1.10 SN-f5), TET12S (TET12 1.10 S-f 5 ), TET12 SScr (TET12ScrS-f5), PYR16SN (PYR16 4.6 SN-f 5 ), och TRIP18SN (TRIP187.5RSN-f5). Kreditera: Naturens bioteknik (2017). DOI:10.1038/nbt.3994
(Phys.org)—Ett stort team av forskare med medlemmar från Slovenien, Storbrittanien, Serbien, Frankrike och Spanien har utvecklat en teknik som får proteiner att självbilda sig till geometriska former vid behov. I deras papper publicerad i tidskriften Natur bioteknik, gruppen beskriver sin teknik och möjliga användningsområden för de små burarna.
På senare år har forskare har manipulerat DNA-strängar för att få dem att binda samman till användbara former (DNA-origami). I denna nya ansträngning, forskarna har gjort något liknande med hjälp av proteiner istället. De inom området tror att sådana föremål kan vara användbara för tillämpningar som att bygga paket för att leverera läkemedel till riktade platser i människokroppen.
För att få proteinerna att självmontera, forskarna tvinnade dubbla strängar av aminosyrasektioner (coiled coils) till aminosyrasträngar som placerades i skurna sektioner av naturligt förekommande proteinsträngar. Forskarna beskriver de lindade spolarna som att likna garnsegment. De sektioner som infördes i kedjan valdes specifikt för att tidigare tester visat att de skulle böjas på önskat sätt när de utsätts för faktorer som elektricitet eller vatten. Resultatet var en enda sträng med böjningar som fick den totala strängen att ta formen av ett geometriskt objekt. Teamet rapporterar att de kunde skapa tetraeder, fyrsidiga pyramider och triangulära prismor. Testning av strukturerna visade att de var lösliga i vattenlösningar och att de kunde ta sina former både inuti och utanför celler. Teamet visade också att strukturerna kunde bildas och möjligen användas i levande möss.
Forskarna noterar att parametrar som laddningen av de lindade spolarna och locket som bildas vid deras ändar kan justeras för att skapa olika former och för att diktera under vilka förhållanden proteinerna självmonterar sig. De rapporterar vidare att det var möjligt att skapa en verktygslåda med byggstenar av strukturerna, möjliggör större, mer komplexa strukturer från grundformerna. De föreslår att sådana konstruktioner kan användas för att bära läkemedel eller vaccinationer genom kroppen eller för att skapa andra strukturer som innehåller aminosyrafunktionalitet.
© 2017 Phys.org