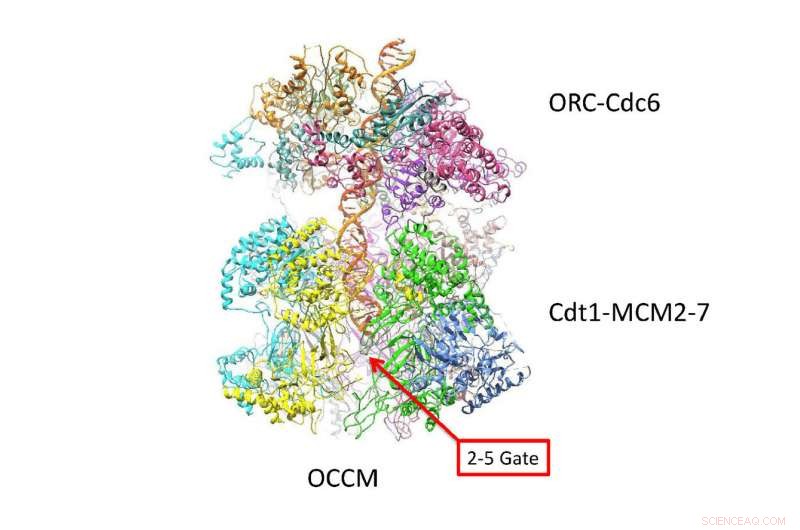
DNA följer en sicksack-bana inuti en kanal skapad av två 6-sidiga ringar. Denna nya atomnivå gjord med cryo-EM-teknik, föreslår hur DNA interagerar med de två ringarna precis innan de separeras i "ledande" och "släpande" strängar. Allt liv beror på absolut exakt koreogrpahi, när en cell är för att replikera sitt DNA för att göra två celler. Kredit:Van Andel Research Institute
Livet skulle vara omöjligt om DNA i delande celler replikerades med något mindre än nästan perfekt precision. Varje gång en cell med kärnor förbinder sig att bli två celler, varje "bokstav" i dess genom måste replikeras en gång och bara en gång. I människor, uppgiften förbryllar fantasin. Om det lindas av, den dubbla helixen som är instoppad i var och en av våra celler skulle vara 6 fot lång. Bara i vår benmärg, en halv miljard nya celler föds varje minut. Enbart dessa celler innehåller tillräckligt med DNA för att svepa runt jordens ekvator 25 gånger. Inom skrämmande toleranser, varje ny cell måste ha ett genom som är identiskt med det hos cellen som födde det. Cancer och andra sjukdomar kan uppstå när processen går snett.
Att ta reda på hur exakt replikering fungerar på nivån för enskilda molekyler och atomer är en av modern vetenskaps stora landvinningar. Utredarnas resa är ännu inte gjord, dock. En stor olöst del av pusslet är att förstå hur hela processen att kopiera genomet börjar. I ny forskning, insikt i hur de två ställningarna av dubbelspiralen separeras i de tidigaste stadierna av replikering blir tydlig.
Ett långvarigt samarbete av forskare i London, Grand Rapids, Michigan and Cold Spring Harbor Laboratory (CSHL) i New York rapporterar strukturen på atomnivå hos tvillinghelikasenzymer laddade huvud mot huvud, med DNA-dubbelhelixen synlig i den cirkulära kanalen som löper genom båda helikaserna. Konfigurationen, en del av det pre-replikativa komplexet (pre-RC), har aldrig framgångsrikt avbildats i den här konfigurationen tidigare.
Bragden möjliggjordes av en ny anläggning för cyro-elektronmikroskopi (cryo-EM) vid Van Andel Research Institute, hem för en av de ledande utredarna, Dr Huilin Li. Dr Li har samarbetat med Dr Bruce Stillman från CSHL och Dr Christian Speck, Professor i genombiokemi och molekylärbiologi vid Imperial College i London i över ett dussin år. 1992, Stillman och kollegor upptäckte proteinkomplexet som kallas ursprungsreplikationskomplexet (ORC), som sätter ihop proteinkomplex på många platser som kallas "startplatser" längs dubbelhelixen, där replikeringen startar. Dr Specks arbete visade att ORC kombineras med andra proteiner – Cdc6, Cdt1 och hexameren av Mcm2-7 – för att påbörja processen att duplicera DNA.
En hel del tidigare ansträngningar har avslöjat hur ORC sätter ihop och hittar startplatser. Det finns många sådana sajter, organiserade efter domäner, i det komplexa mänskliga genomet; många färre i enklare livsformer som bagerijäst. Den nya forskningen handlar om vad som händer efter det första erkännandet av startplatserna och hur DNA-spiralen kan lindas av.
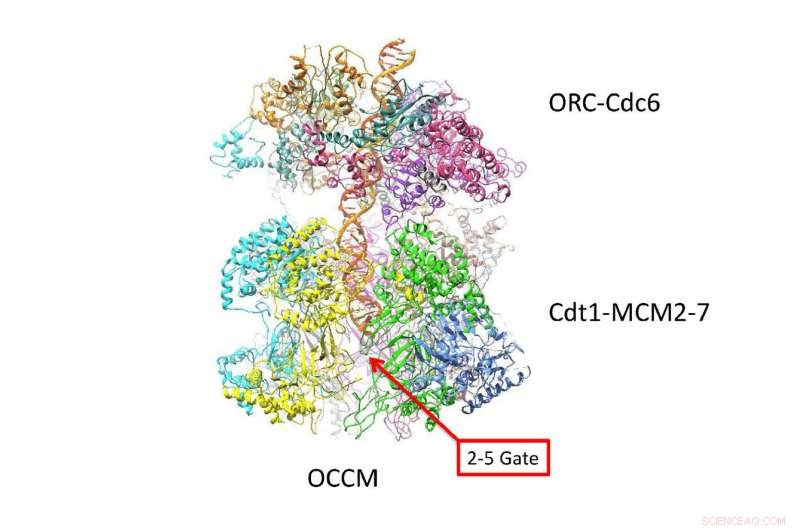
DNA-dubbelhelixen följer en sicksackbana inuti en kanal skapad av två 6-sidiga ringar. Denna nya vy på atomnivå gjord med cryo-EM-teknik, föreslår hur DNA interagerar med de två ringarna precis innan de separeras i "ledande" och "släpande" strängar. Allt liv beror på absolut exakt koreografi, när en cell ska replikera sitt DNA för att göra två celler. Kredit:Van Andel Research Institute
Som tydligt visas i de nya cryo-EM "bilderna, "de dubbla sexsidiga Mcm2-7-helikasenzymer som omger den dubbla helixen ser ut som symmetriska insekter eller, kanske, dubbla rymdfarkoster dockade head to head. Frågan som den nya strukturen besvarar är hur dubbelspiralen ligger i kanalen de bildar, och hur DNA interagerar med den omgivande strukturen. Baserat på den nya kunskapen, insikt i hur de två DNA-strängarna separeras, länge ett mysterium, börjar avslöjas.
"De nya bilderna visar att när de har laddats in i den dubbla hexameren - eller DH, som vi kallar head-to-head helikaser - dubbelspiralen tar en sicksackande väg genom den centrala kanalen, som är typ knäckt, " förklarar författarna. "De två tunnformade hexamererna är placerade på ett sådant sätt att de är redo att vrida dubbla helixen när de aktiveras."
En konsekvens är särskilt viktig:vridningen i strukturen av komplexet som bildas av de dubbla ringarna skapar en vridningspåkänning:de belastar med en inneboende spänning som gör dem till något som en spiralfjäder. Detaljer i strukturen som inte tidigare setts avslöjar hur olika proteinsubenheter av de dubbla hexamererna låser sig på dubbelhelixen, via små loopliknande strukturer.
Scenariot som Li, Fläck, Stillman och deras kollegor är att de dubbla hexamererna laddas i spänning, får en av de två DNA-strängarna som passerar genom dem att bokstavligen hopa sig mot en stängd "dörr" på ena sidan av ringen, och den andra tråden mot en annan stängd "dörr" på motsatt sida. Teamet föreslår att en av de två dörrarna öppnas när replikeringsprocessen aktiveras (genom ingrepp av proteinkinaser och andra hjälpmolekyler).
Genom den öppna dörren i spiralen - men bara på ena sidan - tvingas en tråd av dubbelspiralen ut, eller "extruderade". Teamet föreslår att det blir vad som kallas "lagging strand" i DNA-replikationsprocessen. Den andra strängen, kvar i mitten av den spiralformade kanalen, blir den "ledande strängen" i replikering. Molekylära motorer laddade på de två hexamererna ger energi för deras separation. Den ena aktiverade helikasen passerar den andra, när replikeringen av varje sträng fortsätter i motsatta riktningar, som biologer drog slutsatsen för årtionden sedan.
De senaste strukturerna möjliggjordes av framsteg inom tekniken som kallas kryo-elektronmikroskopi, där en elektronstråle passerar genom frusen, enstaka protein-DNA-partiklar för att erhålla en 3-dimensionell bild på nära atomnivå. De viktigaste utvecklarna av metoden, som nu används flitigt, fick Nobelpriset i kemi 2017.