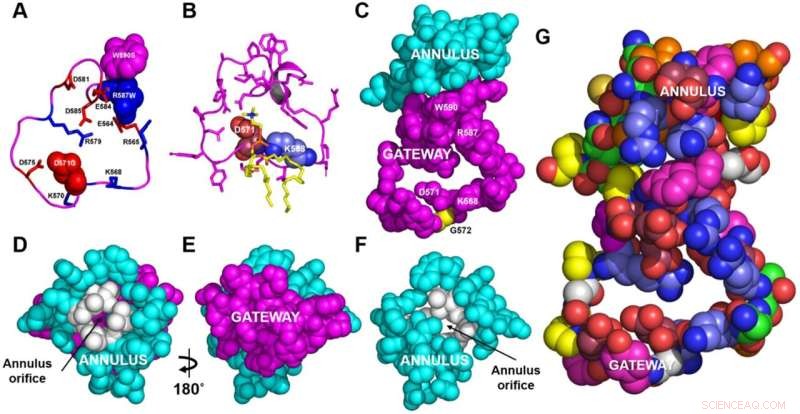
Strukturella detaljer för gateway/ring-komplexet. A, B Ryggraden i gatewayen (magenta). A De basiska (blå, sticka) och sura (röda, stick) aminosyraresterna i gatewayen (resterna 564–592, magenta) från ABCA1-strukturen bestämt av cryo-EM. De tre aminosyraresterna i gatewayen som är kända för att vara muterade i Tangiers sjukdom (totalt fyra punktmutationer) visas i det rymdfyllande läget. B POPC-molekylen (gul stav) bildar saltbryggor till resterna D571 och K568 (rymdfyllande röd respektive blå) i 1,9 µs-ramen under grovkornig molekylär dynamik (CGMD)-modellering av omuterad ABCA1. Alla sidokedjor utom resterna D571 och K568 är magentastick. C Gateway (magenta)/annulus (cyan) komplex. Rester av den långsträckta hydrofoba tunneln som ligger inom 10 Å från någon gateway-rester bildar annulusdomänen (resterna 69, 71–80, 363 och 368–379). D Ringringen (cyan) sett från sidan motsatt den utåtvända transmembrankaviteten. Notera den lilla öppningen (resterna 73–75, 77, 78, 371, 375, färgad vit) i mitten av ringen genom vilken magentafärgade rester av gatewayen på motsatt sida är synliga. E Basen av ringen (D) roterade 180° runt y-axeln för att visa gatewayen. Utsikten är från den utåtvända transmembrankaviteten. F Representation av annulus med gatewayen borttagen för att visa annulus öppningen. G Aminosyrasammansättningen av gateway/annuluskomplexet. Sura rester, ros; basiska rester, blå; aromatiska rester, magenta; hydrofoba rester, orange; proliner, gula; neutrala rester, gröna; glyciner, vit. Kredit:Nature Communications (2022). DOI:10.1038/s41467-022-32437-3
En ny modell tyder på att ett protein som är involverat i genereringen av högdensitetslipoprotein (HDL) fungerar annorlunda än man tidigare trott.
HDL är känt som det "goda kolesterolet" eftersom det flyttar bort fett och kolesterol från artärväggarna och kan hjälpa till att förebygga eller minska åderförkalkning och kranskärlssjukdom.
Jere Segrest, MD, Ph.D., professor i medicin vid avdelningen för kardiovaskulär medicin, och kollegor använde datorsimulering och cellkulturstudier för att utforska hur proteinet ABCA1 transporterar fettmolekyler från cellens plasmamembran till HDL. Forskarna rapporterade i tidskriften Nature Communications att ABCA1 extraherar fosfolipider från den yttre ytan av plasmamembranet, snarare än den inre ytan som tidigare trott.
"Vår modell av ABCA1 som en extracellulär lipidtransportör föreslår en unik transportmekanism som skiljer sig väsentligt från mekanismer som beskrivs för andra medlemmar av denna transportörfamilj," sa Segrest. "Detta överraskande fynd belyser den anmärkningsvärda mångfalden i substrattransport inom ABCA-transportörsuperfamiljen.
"Dessa insikter om mekanismen för ABCA1-transport är viktiga eftersom de pekar på potentiella vägar för att främja ABCA1-beroende fosfolipid- och kolesterolutflöde från kolesterylesterladdade makrofager, som spelar nyckelroller i alla stadier av utvecklingen av aterosklerotisk lesion," tillade Segrest.
Hyun Song, Ph.D., forskarassistent i medicin, använde grovkorniga och styrda molekylära dynamiska simuleringar för att visa att en "gateway"-domän av ABCA1 tar bort fosfolipider från utsidan av membranet och passerar dem genom en ringformad "annulus"-domän till en fettkantad (hydrofob) tunnel.
Medarbetarna Chongren Tang, Ph.D., och Jay Heinecke, MD, vid University of Washington, Seattle, konstruerade mutationer i gateway- och annulusdomänerna för ABCA1-transportören och fann att mutationerna kraftigt hämmade lipidexport av ABCA1 utan att påverka transportörcellen -ytuttryck. + Utforska vidare