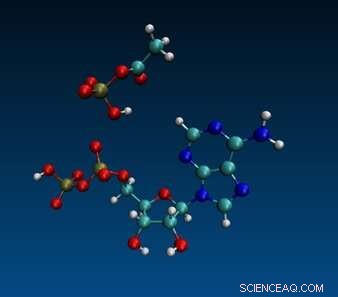
Molekylär dynamisk simulering av ADP och acetylfosfat. Kredit:Aaron Halpern, UCL (CC-BY 4.0, creativecommons.org/licenses/by/4.0/)
En enkel tvåkolsförening kan ha varit en avgörande aktör i utvecklingen av ämnesomsättningen före cellernas tillkomst, enligt en ny studie publicerad den 4 oktober i open access-tidskriften PLOS Biology , av Nick Lane och kollegor vid University College London, U.K. Fyndet kastar potentiellt ljus över de tidigaste stadierna av prebiotisk biokemi och antyder hur ATP kom att bli den universella energibäraren för allt cellulärt liv idag.
ATP, adenosintrifosfat, används av alla celler som en energimellanprodukt. Under cellandning fångas energi när ett fosfat tillsätts till ADP (adenosin difosfat) för att generera ATP; klyvning av det fosfatet frigör energi för att driva de flesta typer av cellulära funktioner. Men att bygga ATP:s komplexa kemiska struktur från grunden är energikrävande och kräver sex separata ATP-drivna steg; även om övertygande modeller tillåter prebiotisk bildning av ATP-skelettet utan energi från redan bildad ATP, menar de också att ATP sannolikt var ganska knapphändig och att någon annan förening kan ha spelat en central roll i omvandlingen av ADP till ATP i detta skede av Evolution.
Den mest troliga kandidaten, trodde Lane och kollegor, var tvåkolsföreningen acetylfosfat (AcP), som idag fungerar i både bakterier och arkéer som en metabolisk mellanprodukt. AcP har visat sig fosforylera ADP till ATP i vatten i närvaro av järnjoner, men en mängd frågor kvarstod efter den demonstrationen, inklusive om andra små molekyler kan fungera lika bra, om AcP är specifik för ADP eller i stället skulle kunna fungera precis som väl med difosfater av andra nukleosider (som guanosin eller cytosin), och om järn är unikt i sin förmåga att katalysera ADP-fosforylering i vatten.
I sin nya studie utforskade författarna alla dessa frågor. Med hjälp av data och hypoteser om jordens kemiska förhållanden innan livet uppstod, testade de förmågan hos andra joner och mineraler att katalysera ATP-bildning i vatten; ingen var nästan lika effektiv som järn. Därefter testade de en panel av andra små organiska molekyler för deras förmåga att fosforylera ADP; ingen var lika effektiv som AcP, och endast en annan (karbamoylfosfat) hade någon signifikant aktivitet alls. Slutligen visade de att ingen av de andra nukleosid-difosfaterna accepterade ett fosfat från AcP.
Genom att kombinera dessa resultat med molekylär-dynamisk modellering föreslår författarna en mekanistisk förklaring för specificiteten hos ADP/AcP/järnreaktionen, och antar att järnjonens lilla diameter och höga laddningstäthet, kombinerat med konformationen hos den mellanprodukt som bildas när de tre möts och ger en "precis rätt" geometri som gör att AcP:s fosfat kan byta partner och bilda ATP.
"Våra resultat tyder på att AcP är den mest rimliga föregångaren till ATP som en biologisk fosforylator," säger Lane, "och att uppkomsten av ATP som cellens universella energivaluta inte var resultatet av en "frusen olycka", utan uppstod. från de unika interaktionerna mellan ADP och AcP. Med tiden, med uppkomsten av lämpliga katalysatorer, kan ATP så småningom ersätta AcP som en allestädes närvarande fosfatdonator, och främja polymerisationen av aminosyror och nukleotider för att bilda RNA, DNA och proteiner."
Huvudförfattaren Silvana Pinna tillägger, "ATP är så centralt för ämnesomsättningen att jag trodde att det kunde vara möjligt att bilda det från ADP under prebiotiska förhållanden. Men jag trodde också att flera fosforyleringsmedel och metalljonkatalysatorer skulle fungera, särskilt de som bevaras i livet. Det var mycket överraskande att upptäcka att reaktionen är så selektiv – i metalljonen, fosfatdonatorn och substratet – med molekyler som livet fortfarande använder. Det faktum att detta sker bäst i vatten under milda, livskompatibla förhållanden är egentligen ganska betydelsefullt för livets ursprung." + Utforska vidare