Grafiskt abstrakt. Kredit:Molecular Cell (2022). DOI:10.1016/j.molcel.2022.06.024
Publicerad i Molecular Cell tidskriften den 19 juli visade en forskningsstudie från Hatters Laboratory att olämplig proteinaggregation är kopplad till dåliga resultat för cellhälsa och överlevnad - särskilt i neuroner i neurodegenerativa sjukdomar.
Studien undersökte de molekylära drivkrafterna som gör att felveckade proteiner klibbar ihop onormalt och tittade på effekten av klibbiga proteiner på de omgivande proteinerna i en cell, särskilt hur proteostassystem upptäcker dessa klibbiga proteiner för att förhindra att de aggregerar.
Forskningen är ett resultat av ett samarbete mellan professor Rohit Pappu vid Washington University, forskare från University of Melbourne inklusive Ph.D. student och jämställd första författare, Yoon Hee Choi, professor David Ascher, Dr. Dezerae Cox och Angelique Haynes och forskare från University of Leeds.
"Vi fann att det fanns särskilda proteiner som normalt reglerar proteinveckning - så kallade molekylära chaperoner - som är mycket specifika för att upptäcka speciella klistermärken. Detta är ett viktigt fynd eftersom det informerar om hur celler upptäcker när proteiner aggregeras onormalt", säger professor Hatters.
Proteiner är grundläggande för cellers funktion och cellöverlevnad och proliferation kräver proteiner för att vika och binda andra proteiner.
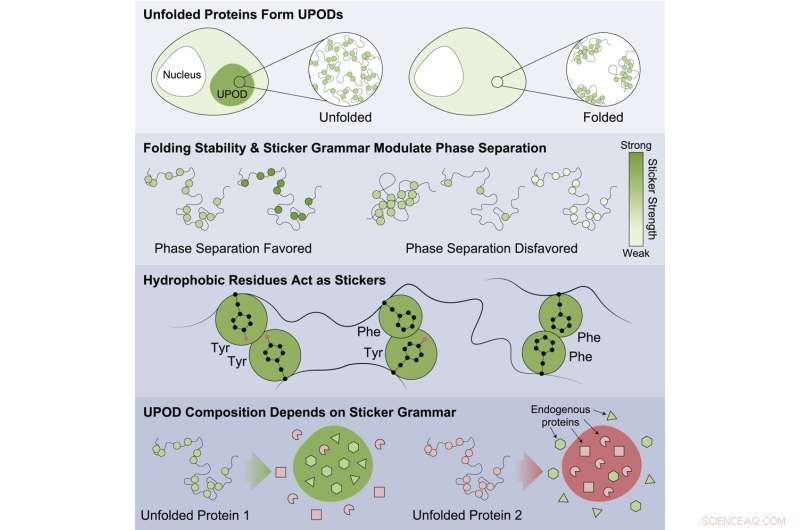
"När proteiner inte viker sig ordentligt, kan mellanliggande "felveckade" former - kända som oveckade proteinavlagringar (UPODs) - hålla ihop till aggregat. Sådana aggregat uppstår i många sjukdomsmiljöer, när de molekylära systemen som styr proteinveckning och clearance "proteostas" ' bryta ihop", sa Choi.
Studien visade att proteiner som var mindre stabila var mer benägna att aggregera och vara associerade med sjukdom. Fynden tyder på att detta görs genom den olämpliga aggregeringen av felvikta former med olika underenheter som känner av olika "klistermärke"-koder som styr aggregeringen. Proteinerna är involverade i ett stort antal sjukdomar inklusive cancer, medfödda sjukdomar, nervsystemsjukdomar, metabolismstörningar och hudsjukdomar.
Specifika mönster av klistermärken hittades som var viktiga för att styra aggregering och som gjorde att andra omgivande åskådarproteiner i cellen samlagrades. Arbetet visade att vissa klasser av aminosyror var de bästa klistermärkena – tyrosin och fenylalanin – och att mönstret för aminosyrorna var viktigt för hur åskådarproteiner aggregerades på ett olämpligt sätt och hur molekylära chaperoner kände igen de aggregat som bildades.
"Nästa steg är att bättre förstå mekanismerna för detta. Detta kan vara användbart i framtida ansträngningar att omprogrammera celler för att bättre rensa ut proteinaggregat, till exempel vid sjukdomar där de ackumuleras i stor utsträckning", säger professor Hatters.