
Effektiv kommunikation mellan celler är avgörande för många biologiska processer, som att rekrytera immunceller för att bekämpa sjukdomar. Den snabba frisättningen av minst 80 signalmolekyler, inklusive tumörnekrosfaktor och epidermal tillväxtfaktor, kontrolleras av ett membranbundet proteas som kallas ADAM17.
Denna process innebär att ADAM17 klyver (avsöndrar) signalmolekylerna från deras prekursorformer i en cells membran. "Pseudoproteaset" iRhom2 hjälper till med mognad och transport av ADAM17. Bristen på strukturell insikt har dock lämnat de mekanismer som ligger bakom denna process otydliga.
Publicerad idag i Molecular Cell , har forskare från St. Jude Children's Research Hospital och University of Oxford använt kryo-elektronmikroskopi för att avslöja en serie strukturer av det mänskliga ADAM17/iRhom2-komplexet i både aktiva och inaktiva tillstånd. Dessa strukturer visar att iRhom2 fungerar som en gatekeeper till ADAM17:s livscykel, och interagerar med nyckelregioner i ADAM17 som styr dess aktivitet.
Arbetet erbjuder också potentiella vägar för läkemedelsdesign för att bekämpa sjukdomar med kronisk inflammation och autoimmun dysregulation. "Vi tror att det finns potential att designa små molekyler som riktar in sig på iRhom2 istället för ADAM17 direkt, eller gränssnittet mellan iRhom2 och ADAM17", säger medförfattare, Chia-Hsueh Lee, Ph.D., St. Jude Department of Structural Biology .
iRhom2 är ett pseudoproteas:Det har alla strukturella egenskaper hos ett proteas från rhomboidfamiljen, förutom att det saknar den proteasdefinierande förmågan att klyva proteiner. Men som en gammal hund som lär sig nya trick, spelar iRhom2 nyfunna roller i byggnadsställningar och transporter av ADAM17.
Som strukturella studier visade, börjar iRhom2s inverkan på ADAM17-funktionen under den initiala syntesen av de två proteinerna. "Det endoplasmatiska retikulumet är där ADAM17 och iRhom2 görs, och i detta skede bildar de ett komplex," förklarade Lee. iRhom2 underlättar sedan transport av ADAM17 till Golgi-apparaten för mognad, där det tidigare konceptet med att iRhom2 endast tjänade som en "passiv byggnadsställning" sattes på prov av Lees strukturer.
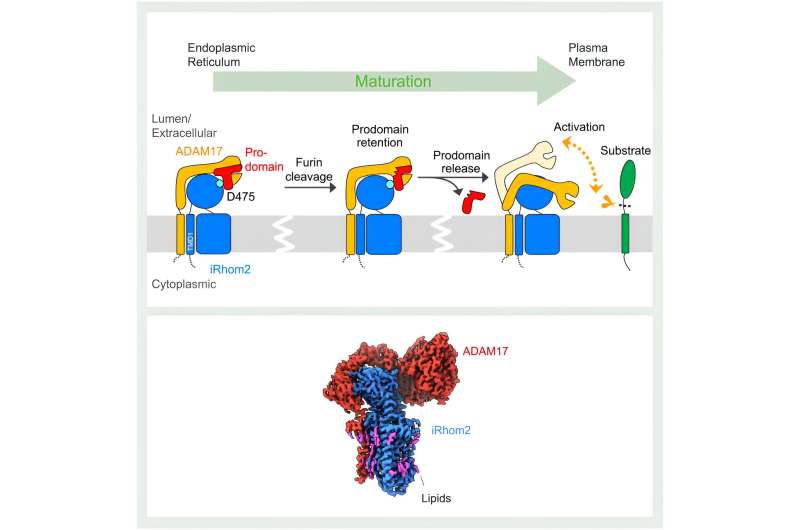
Interaktionen mellan iRhom2 och ADAM17 antogs uteslutande ske mellan proteinernas transmembrandomäner, som fäster proteinerna till cellmembranet. Till forskarnas förvåning interagerar de två proteinerna också genom sina extracellulära regioner. Genom dessa interaktioner håller iRhom2 fast i en viktig region av ADAM17 som kallas prodomänen. Prodomänen är en region som fungerar som en säkerhetsnål på en brandsläckare.
"ADAM17 i sig är självinhiberad. Den har ett prodomänlock för att blockera sin egen proteasplats", förklarade Lee.
Inom Golgi-apparaten är denna självreglerande prodomänhatt klyvd. Men iRhom2 behåller ADAM17-locket tills komplexet når cellmembranet. Detta steg är avgörande för att förhindra för tidig aktivering av ADAM17. De nya strukturerna avslöjar att ADAM17 aktiveras när locket tas bort. Denna aktivering kännetecknas av en betydande vinst i flexibilitet, vilket gör att ADAM17 kan söka i sitt omgivande utrymme efter substrat.
ADAM17 har visat sig spela en roll i utvecklingen och progressionen av flera cancertyper; ADAM-familjen av proteiner är dock väl bevarad. Ett läkemedel som riktar sig mot ADAM17 kan leda till effekter utanför målet. Lee är optimistisk att strukturerna kan erbjuda en plan för uppfinningsrikedom för läkemedelsdesign.
"Baserat på vår modell, om vi kunde hålla ihop dessa två proteiner, till exempel genom ett bindemedel som förbättrar interaktionen mellan iRhom2 och ADAM17, så kommer iRhom2 inte att släppa prodomänlocket", sa Lee. "Detta kommer att avsevärt minska ADAM17-aktiviteten."
Studiens första författare är Fangfang Lu, University of Oxford och Hongtu Zhao, St. Jude. Studiens andra motsvarande författare är Hongtu Zhao, St. Jude och Matthew Freeman, University of Oxford. Studiens ytterligare författare är Yaxin Dai och Yingdi Wang, St. Jude.
Mer information: Fangfang Lu et al, Cryo-EM avslöjar att iRhom2 begränsar ADAM17-proteasaktivitet för att kontrollera frisättningen av tillväxtfaktor och inflammatoriska signaler, Molecular Cell (2024). DOI:10.1016/j.molcel.2024.04.025
Journalinformation: Molekylär cell
Tillhandahålls av St. Jude Children's Research Hospital