Forskare under ledning av prof. Zhang Zairong från Shanghai Institute of Organic Chemistry vid den kinesiska vetenskapsakademin har identifierat en post-translationell topogenesväg för veckning och sammansättning av multi-spann membrane proteins (MSPs).
Av de cirka 5 000 membranproteiner som syntetiseras vid det endoplasmatiska retikulummembranet (ER) hos mänskliga celler är mer än hälften MSP:er som spelar avgörande roller i cellulär och organismfysiologi, och fungerar som jonkanaler, transportörer, receptorer och intramembranenzymer.
En betydande del av dessa funktioner är beroende av polära och laddade aminosyror, vilket leder till bildandet av dåligt hydrofoba TMD:er (pTMD). Men pTMD står inför utmaningar när det gäller att känna igen och integreras i fosfolipiddubbelskiktet av Sec61-translokonet, som föredrar hydrofoba TMDs.
I det mänskliga proteomet innehåller cirka 30 % av membranproteinerna och mer än 50 % av MSP:er minst en pTMD. Hur dessa pTMD effektivt identifieras och exakt paketeras i mogna MSP-strukturer har varit en stor vetenskaplig fråga.
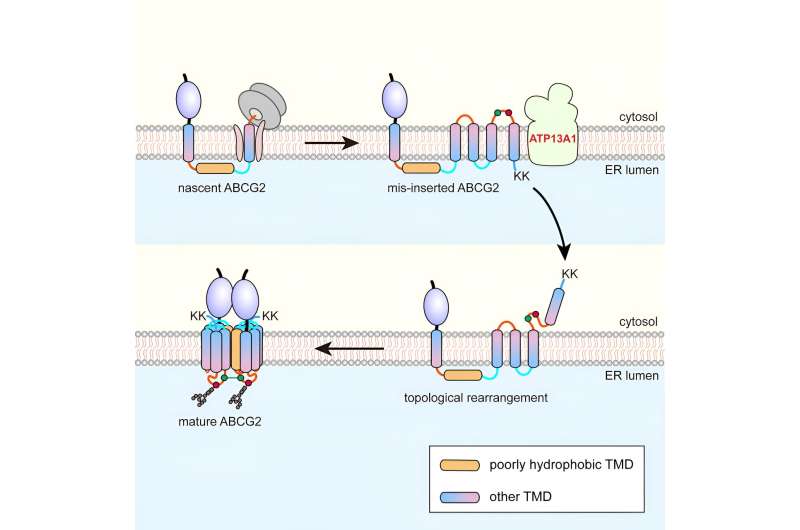
Genom att använda den sexspännande proteinadenosintrifosfatbindande kassetttransportören G2 (ABCG2) som modell, fann forskarna att under co-translationell translokation passerar ABCG2:s pTMD2 genom den centrala poren i translokonet in i ER-lumenet, snarare än att integreras i fosfolipiddubbelskiktet genom translokonets laterala grind.
Detta resulterar i införandet av nedströms TMD i ER-membranet med omvänd orientering, vilket bildar en unik mellanprodukt. Efter translationen av de C-terminala positivt laddade tvillinglysinresterna inträffar en nära-global topologisk omarrangemang.
Affinitetsrening visade att ATP13A1 kan detektera den C-terminala positiva laddningssignalen för ABCG2. Ersättning av lysinrester med negativt laddade eller neutrala aminosyror försvagar signifikant interaktionerna mellan ATP13A1- och ABCG2-mutanter.
Dessutom resulterade knockout av ATP13A1 i den uppenbara ackumuleringen av felveckade ABCG2-konformationer, främst de med felorienterad TMD6 i ER-membranet. Således spelar ATP13A1 en avgörande roll i topogenesen av MSP, där dess ATPas-aktivitet främjar dislokationen av den felorienterade TMD6 från lipiddubbelskiktet in i cytosolen.
Därefter återintegreras den cytosoliska TMD6 i ER-membranet, vilket driver den posttranslationella topologiska omarrangemanget av andra uppströms TMD:er.
Efter framgångsrik omarrangering av TMD 4-6 kan mellanprodukten oligomerisera till en kvartär struktur. Denna process kommer sannolikt att underlätta integrationen av pTMD2 i den slutliga strukturen från det vattenhaltiga ER-lumenet och in i den mogna strukturen, som är tätt omsluten av omgivande TMD.
Sammanfattningsvis, studien, nu publicerad i Molecular Cell , förklarar hur en "svår" pTMD co-translationellt hoppas över för insättning och post-translationellt begravs i den slutgiltiga korrekta strukturen i det sena veckningsstadiet, vilket undviker överdriven lipidexponering.
På grund av exponeringen av pTMD2 för ER-lumen under ABCG2-topogenesen, kan N441-glykosyleringsmodifieringen orsakad av den genetiska mutationen ABCG2-S441N avsevärt blockera pTMD-montering i det sena stadiet av topogenesen. Eftersom ABCG2 är en urinsyratransportör förklarar denna studie hur denna mutation är nära förknippad med mänskliga sjukdomar som gikt och hyperurikemi.
Mer information: Jia Ji et al, En ATP13A1-assisterad topogenesväg för vikning av flerspännande membranproteiner, Molecular Cell (2024). DOI:10.1016/j.molcel.2024.04.010
Journalinformation: Molekylär cell
Tillhandahålls av Chinese Academy of Sciences