Australiska forskare har belyst de formskiftande förmågan hos proteinsammansättningar, med resultat som kan revolutionera områden från biotillverkning till vaccinutveckling.
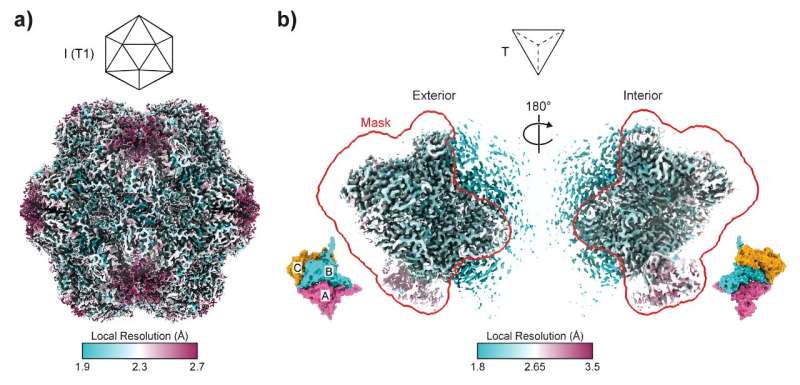
Under ledning av University of Sydneys Dr Taylor Szyszka och Dr Yu Heng Lau, från ARC Center of Excellence in Synthetic Biology, publicerades idag forskning i Proceedings of the National Academy of Sciences fördjupar sig i enkapsulins intrikata värld. Dessa icosaedriska proteinburar spelar en avgörande roll för att tillverka nanoreaktorer, med deras porer som fungerar som dörrar till små nanofabriker.
"Genom att manipulera porerna och ändra deras storlek och laddning kan vi få bättre kontroll över substrat som kommer in i burarna och förvandlas till produkter av de enzymer som förpackas inuti", säger Dr. Szyzska.
Teamets utforskning tog dock en oväntad vändning när de började göra små mutationer för att observera effekterna.
Denna rullning av molekylärtärningarna ledde till skapandet av strukturer som liknar tetraedrar, en pyramidform som skiljer sig mycket från de vanliga sfäriska inkapslingarna. När det gäller monteringsform är det ungefär som att ändra en 20-sidig tärning till en fyrsidig tärning. Dessa tetraedriska sammansättningar, som bara består av 36 proteinsubenheter jämfört med de vanliga 180, öppnar upp en värld av möjligheter som tidigare outforskade inom proteinteknik
"Vad vi fann är att minimala mutationer krävs för att drastiskt ändra formen på den slutliga monteringen", säger Dr. Szyszka. "Vi förväntade oss att det skulle bli en mycket mer komplicerad process."
Studiens resultat utmanar inte bara befintliga förståelser av proteinsammansättning utan erbjuder också insikter i evolutionär biologi. Encapsulins, även om de inte själva är virus, delar evolutionära band med virala strukturer. Forskarna spekulerar i att den flexibilitet som observeras i inkapsuliner kan tillskrivas deras mindre laststorlek jämfört med virus, vilket potentiellt kan påverka deras förmåga att anta olika former.
"Denna upptäckt tyder på att det finns andra former som vi kan göra, med breda konsekvenser för bioteknik och biotillverkning," säger Dr. Szyszka.
Med ytterligare forskning hoppas teamet kunna frigöra den fulla potentialen hos dessa formskiftande proteiner, vilket banar väg för innovationer som kan omforma industrier och förbättra människors hälsa.
Mer information: Taylor N. Szyszka et al, Punktmutation i en virusliknande kapsid driver symmetrireduktion för att bilda tetraedriska burar, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2321260121
Journalinformation: Proceedings of the National Academy of Sciences
Tillhandahålls av ARC Center of Excellence in Synthetic Biology (CoESB)