Forskare från Kumamoto University har identifierat en ny värmechockfaktor (HSF), betecknad som HSF5, som spelar en avgörande roll i fullbordandet av meios och aktiveringen av gener som är nödvändiga för spermiebildning. Denna upptäckt ger värdefulla insikter om bakomliggande orsaker till spermatogent misslyckande, den största bidragsgivaren till manlig infertilitet.
Dessutom, till skillnad från andra typiska värmechockfaktorer, som primärt reglerar genuttryck som svar på stress, såsom värmechock, spelar HSF5 en specifik roll i manlig bakterieproduktion under meios under icke-stressförhållanden.
Vid eukaryot celldelning fördelas genomisk information jämnt till dotterceller under mitos, medan den halveras under en specialiserad typ av celldelning som kallas meios, vilket är nödvändigt för könscellsproduktion. I manliga könsceller följer spermiebildningen efter fullbordandet av meios, med flera genreglerande program.
Mekanismerna som styr meiotisk progression och de specifika transkriptionsfaktorerna som är involverade är dock fortfarande dåligt förstådda, vilket innebär betydande utmaningar inom reproduktionsmedicin, särskilt när det gäller manlig infertilitet.
För att komma till rätta med dessa luckor strävar professor Kei-ichiro Ishiguro, biträdande professor Ryuki Shimada och deras forskargrupp på att klargöra mekanismerna som reglerar manlig meios som leder till spermieproduktion, med fokus på identifiering och karakterisering av relaterade transkriptionsfaktorer. Artikeln är publicerad i tidskriften Nature Communications .
I en tidigare studie identifierade teamet en meiosväxlingsgen MEIOSIN, som aktiverar uttrycket av hundratals gener involverade i spermiebildningen. Bland dessa gener uppstod värmechockfaktor som ett fokus för testiklar på grund av testiklarnas känslighet för värmestress, givet deras yttre positionering, som håller en temperatur på 3–4 grader Celsius lägre än kroppens inre temperatur på 37 grader Celsius.
Även om huvudrollerna för värmechockfaktorer som HSF1, HSF2, HSF3 och HSF4 har identifierats väl, är funktionen för HSF5 fortfarande oklar.
"Om HSF5 delar liknande funktioner med andra värmechockfaktorer eller uppvisar helt andra funktioner ställer en spännande fråga, och att ta itu med denna fråga var den ursprungliga avsikten med vår studie", förklarar professor Ishiguro.
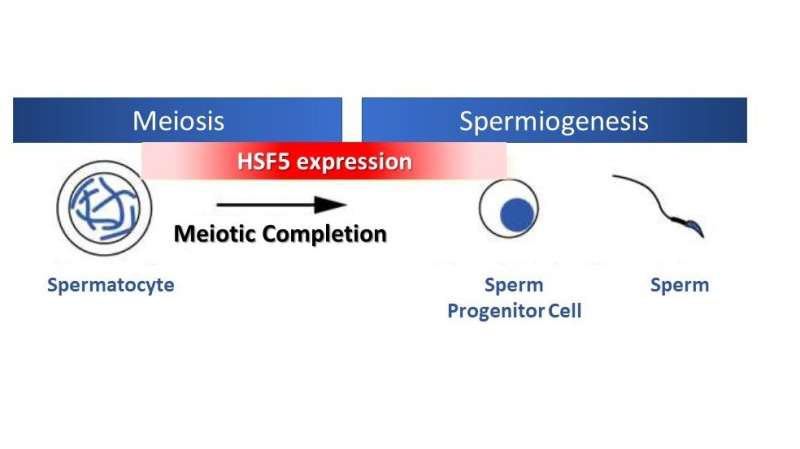
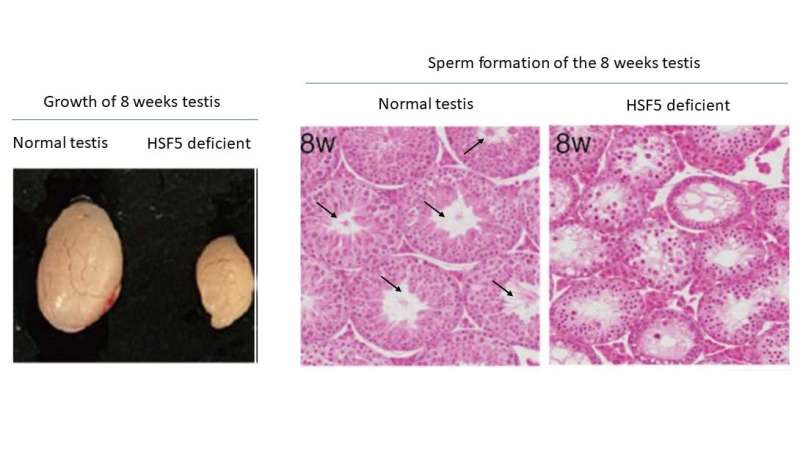
Överraskande nog, till skillnad från andra HSFs som svarar på stress, visade studien att HSF5 spelar en viktig roll i den meiotiska profas-progressionen i manliga könsceller under icke-stressförhållanden. HSF5 krävs för progression bortom pakytenstadiet under spermatogenes, vilket styr det meiotiska programmet mot fullbordande och aktiverar gener associerade med spermiebildning.
Precis som andra transkriptionsfaktorer binder HSF5 till DNA-promotorer för att reglera genuttryck. Det som utmärker HSF5 är dess unika målspecificitet. Forskningen avslöjade att DNA-motivet som det känner igen för bindning till genpromotor skiljer sig från de som är bundna av andra kanoniska HSF-familjens transkriptionsfaktorer.
Alla dessa fynd understryker HSF5:s atypiska roll i genuttryck under meiotisk profas hos män.
Resultaten av denna studie validerades genom experiment på möss, med ett avgörande erkännande att HSF5 också finns hos människor. Med tanke på att många bakomliggande orsaker till infertilitet hos människor, särskilt i fall av spermatogen svikt, fortfarande är svårfångade, förväntas resultaten av denna studie bidra väsentligt till att förstå patogenesen av manlig infertilitet.
Mer information: Saori Yoshimura et al, Atypisk värmechock-transkriptionsfaktor HSF5 är avgörande för manlig meiotisk profas under icke-stressförhållanden, Nature Communications (2024). DOI:10.1038/s41467-024-47601-0
Journalinformation: Nature Communications
Tillhandahålls av Kumamoto University