Forskare har avslöjat den reglerande mekanismen för ett specifikt protein som spelar en nyckelroll för att balansera immunsvaret som utlöses av virusinfektioner i däggdjursceller. Dessa fynd kan hjälpa till att driva utvecklingen av antivirala terapier och nukleinsyraläkemedel för att behandla genetiska störningar. Forskningen är publicerad i tidskriften Nucleic Acids Research .
För att celler ska skydda sig mot virusinfektioner uppstår vanligtvis en serie immunsvar, inklusive programmerad celldöd som kallas apoptos och interferonsignalering. Även om apoptos är en normal process, som sker med eller utan närvaro av virala molekyler, efter en kaskad av steg för att sluta med döden av en cell – vilket kanske inte låter fördelaktigt för värden – kan det hjälpa till att förhindra reproduktion av onormala celler , inklusive de som är infekterade av virus, och eliminera dem från kroppen.
Interferoner, å andra sidan, är proteiner som produceras av djurceller som svar på en virusinfektion för att skydda cellen mot virusangrepp och förhindra viruset från att replikera. Den reglerande mekanismen för hur celler upprätthåller en balans mellan apoptos och interferonsvar för att effektivt undertrycka virusreplikation under infektion förblev dock oklart.
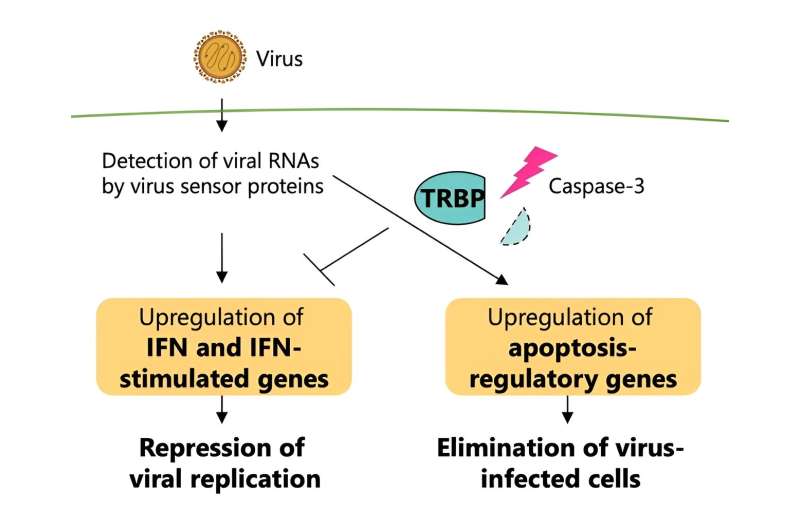
I den aktuella studien fokuserade ett team med forskare från Tokyos universitet på ett specifikt protein, TRBP, som också klassificeras som en typ av protein som kallas en RNA-tystnadsfaktor.
RNA är en nukleinsyra, en organisk förening som finns i levande celler och virus, som styr proteinsyntesen och den genetiska sammansättningen av många virus. RNA syntetiserar proteiner genom en process som kallas translation, genom att läsa genetiska sekvenser och översätta dem till instruktioner för cellerna att skapa proteiner, som mestadels är ansvariga för den övergripande strukturen och funktionen hos organismen, oavsett om det är en växt eller ett djur.
RNA-tystnad, även känd som RNA-interferens, är ett sätt som växter och ryggradslösa djur kan skydda sig mot virus genom att klyva viralt RNA för att undertrycka viral replikation.
"Denna studie ger en betydande insikt som tydligt avslöjade att proteinet relaterat till RNA-tystnadsmekanismen, som är känd för att vara en antiviral mekanism i en växt eller ryggradslösa djur, är starkt relaterad till antiviralt svar även hos däggdjur genom en annan mekanism," sa co- författaren Tomoko Takahashi, gästforskare vid University of Tokyo och biträdande professor vid Saitama University i Japan.
Även om det är allmänt känt att RNA-tystnad är en mekanism som fungerar under normala förhållanden för att kontrollera genuttryck (om genen är "påslagen" för att ge instruktioner för cellen att sätta ihop det specifika protein den kodar för), är det fortfarande oklart hur denna process uppstår under stress av virusinfektion.
Så forskarna tittade på TRBP (en förkortning för TAR RNA-bindande protein), som har visat en betydande roll i RNA-tystnad under en virusinfektion.
Detta protein interagerar med ett virussensorprotein tidigt i infektionsfaserna i mänskliga celler. I de senare stadierna av virusinfektion aktiveras proteiner som kallas kaspaser, och denna typ av protein är främst ansvarig för att utlösa celldöd.
"RNA-tystnad och interferonsignalering ansågs tidigare som oberoende vägar, men flera rapporter, inklusive våra, har visat överhörning mellan dem", säger Kumiko Ui-Tei, en annan medförfattare och docent från University of Tokyo (vid tiden för studien).
Denna funktionella omvandling av TRBP som utlöses av virusinfektion är grunden för att reglera interferonsvar och apoptos, med TRBP irreversibelt ökad programmerad celldöd hos infekterade celler, samtidigt som interferonsignalering minskar. TRBP verkar på cellen genom att inducera celldöd, stoppa den virala replikationen helt, i motsats till interferonsvarsvägen, som bara dämpar viral replikation istället för att eliminera de infekterade cellerna.
"Det slutliga målet är att förstå den molekylära mekanismen bakom det antivirala försvarssystemet, orkestrerat genom samspelet mellan interna och externa RNA-vägar i mänskliga celler", säger Takahashi.
Genom att få en djupare förståelse för hur försvar mot virus fungerar på molekylär nivå, siktar forskarna på att driva utvecklingen av nukleinsyraläkemedel. Dessa läkemedel använder sig av inriktning och hämningsmetoder som liknar det antivirala svaret av RNA-tystnad, och de lovar att bli allt mer användbara vid behandling av ett bredare spektrum av patienter som drabbats av virusinfektioner, genetiska mutationer och genetiska defekter.
Denna studie genomfördes i samarbete med Saitama University, Chiba University, Kyoto University och Maebashi Institute of Technology i Japan.
Mer information: Caspas-medierad bearbetning av TRBP reglerar apoptos under virusinfektion, Nucleic Acids Research (2024). DOI:10.1093/nar/gkae246
Journalinformation: Nukleinsyraforskning
Tillhandahålls av University of Tokyo