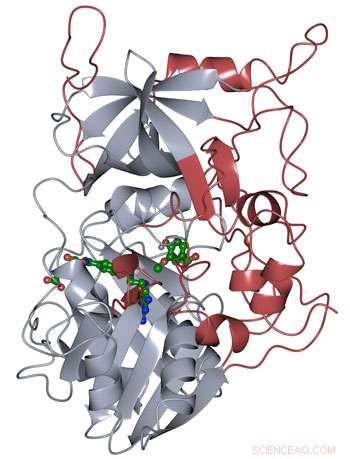
Proteinstrukturen för LigM bestämdes med hjälp av röntgenkristallografi, avslöjar nya strukturella element som är unika för LigM (röd) förutom en konserverad tetrahydrofolatbindande domän (grå) som finns under hela livet. LigM binder till sina substrat (grönt) med interna bindningshåligheter. Kredit:Amanda Kohler/JBEI
Ett protein som används av vanliga jordbakterier ger nya ledtrådar i ansträngningen att omvandla arylföreningar, en vanlig avfallsprodukt från industri- och jordbruksmetoder, till något av värde.
Forskare vid Department of Energy Lawrence Berkeley National Laboratory (Berkeley Lab) och Sandia National Laboratories som arbetar vid Joint BioEnergy Institute (JBEI) har löst proteinstrukturen för enzymet LigM, som används av jordbakterien Sphingomonas för att metabolisera arylföreningar som härrör från lignin, den stela, organiskt material som ger växter sin struktur.
Deras arbete rapporteras idag i Proceedings of the National Academy of Sciences .
Vid produktion av biobränsle, arylföreningar är en biprodukt av nedbrytningen av lignin. Många av de vägar som leder till nedbrytningen av lignin involverar demetylering, vilket ofta är en kritisk föregångare till eventuella ytterligare steg vid modifiering av lignin-härledda arylföreningar.
Studiens huvudförfattare Amanda Kohler, JBEI postdoktor vid Sandia, noterade att LigM är ett attraktivt demetylas för användning vid aromatisk omvandling eftersom det är en enkel, enkel-enzymsystem. LigM kan också behålla sin funktionalitet över ett brett temperaturområde.
"När vi försöker bygga nya vägar inom syntetisk biologi, ju enklare systemet desto bättre, sa Kohler.

Postdoktor Amanda Kohler sätter upp enzymreaktioner som en del av JBEI:s Enzyme Optimization Group. Kredit:Marilyn Chung/Berkeley Lab
Forskarna fann att hälften av LigM-enzymet var homologt med kända strukturer med en tetrahydrofolatbindande domän som finns i både enkla och komplexa organismer. Den andra halvan av LigM:s struktur är helt unik, tillhandahåller en startpunkt för att bestämma var dess arylsubstratbindningsställe är beläget. De kom också på att LigM är ett tyrosinberoende demetylas.
"Det är den första i sitt slag som identifieras, ", sa Kohler. "Denna forskning ger den välbehövliga grunden för att hjälpa till med utvecklingen av ett enzymbaserat system för att omvandla aromatiska avfallsprodukter till något användbart."
Kohler sa att de nu arbetar med att konstruera LigM så att den kan agera på ett bredare utbud av arylsubstrat förutom att rikta in sig på specifika arylavfallsprodukter.