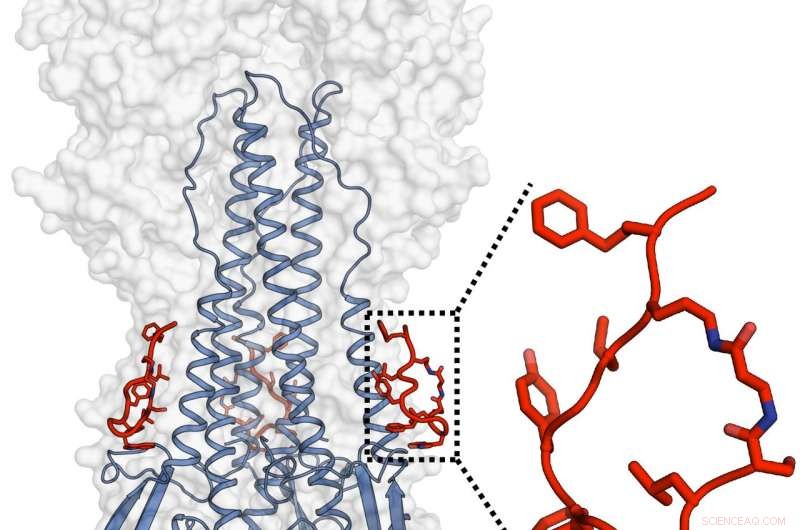
Janssen- och TSRI-teamen designade och karakteriserade en potent peptid som efterliknade funktionen hos en brett neutraliserande antikropp och som också kunde rikta in sig på hemagglutinin från influensavirus. Kredit:Rameshwar U. Kadam (Ian Wilson's Lab)
Ett team av forskare från The Scripps Research Institute (TSRI) och Janssen Research &Development (Janssen) har tagit fram artificiella peptidmolekyler som neutraliserar ett brett spektrum av influensavirusstammar. Peptider är korta kedjor av aminosyror - som proteiner men med mindre, enklare strukturer. Dessa designade molekyler har potential att utvecklas till läkemedel mot influensa, vilket orsakar upp till 500, 000 dödsfall över hela världen varje år och kostar amerikaner miljarder dollar i sjukdagar och förlorad produktivitet.
De utvecklade peptiderna blockerar smittsamheten hos de flesta cirkulerande stammar av grupp 1-influensa A-virus, inklusive H5N1, en fågelinfluensastam som har orsakat hundratals mänskliga infektioner och dödsfall i Asien, och svininfluensastammen H1N1 som orsakade en global pandemi 2009-10.
Forskarna designade peptiderna för att efterlikna de virusgripande regionerna i två nyligen upptäckta "superantikroppar" som är kända för att neutralisera praktiskt taget alla influensa A-stammar. Antikroppar är stora proteiner som är dyra att producera och måste tillföras genom injektion eller infusion. Medan "Peptiderna som utvecklats i studien har potential att bli läkemedel som levereras via pillerbaserade läkemedel i framtiden."
"Att göra små molekyler som i huvudsak gör vad dessa större, brett neutraliserande antikroppar är en riktigt spännande och lovande strategi mot influensa, som våra nya resultat visar, "sa med-senior utredaren Ian Wilson, Hansen professor i strukturbiologi vid TSRI.
Rapporten om de nya peptiderna dök upp som en första utgåva online i Vetenskap den 28 september, 2017.
De två superantikropparna mot influensa som dessa peptider är baserade på, kallas FI6v3 och CR9114, upptäcktes 2011 och 2012. Sedan dess har Wilsons laboratorium vid TSRI i samarbete med Janssen och andra strukturbiologiska laboratorier runt om i världen har kartlagt i atomär skala hur dessa och andra brett neutraliserande antikroppar binder till influensavirus.
En forskargrupp ledd av David Baker vid University of Washington använde nyligen dessa antikroppsstrukturdata för att designa nya proteiner, mindre än antikropparna, som binder till influensavirus på ett liknande sätt och neutraliserar ett brett spektrum av influensastammar. Den nya insatsen av TSRI i samarbete med Janssen-forskare syftade till utvecklingen av ännu mindre icke-proteinliknande molekyler som skulle träffa samma målregion på influensavirus.
Efter flera omgångar av molekylär design och syntes, virusbindningstestning, och strukturell utvärdering på atomnivå, forskargruppen utvecklade en uppsättning av fyra peptider med cirkulära, "cykliska" strukturer som fungerade bra som potentiella influensablockerande molekyler.
Peptiderna visade hög bindningsaffinitet för en bred uppsättning grupp 1-influensa A-virus, samt en potent förmåga att neutralisera infektioner med dessa virus i laboratorieförsöken. Målgrupp 1-influensa A-virus inkluderar H1, H2, H5 och H6 subtyper.
Peptiderna innehåller också aminosyra byggstenar som inte finns i naturliga proteiner, och detta, liksom deras cykliska strukturer, gjort dem relativt resistenta mot de enzymer som annars snabbt kan rensa bort peptidläkemedel från blodomloppet. Den mest optimerade av de fyra peptiderna, heter P7, överlevde i timmar när de exponerades för mus eller mänsklig blodplasma, eller när det injiceras i möss.
"Dessa peptider har läkemedelsliknande stabilitet och kommer att vara goda kandidater för ytterligare testning av antiviral effekt i djurmodeller, "sade Rameshwar U. Kadam, en senior postdoktoral forskarassistent vid Wilson Laboratory som är medförfattare till studien tillsammans med Jarek Juraszek, rektor vid Janssen.
Peptiderna, som antikropparna är de utformade för att efterlikna, binder till en plats som kallas det hydrofoba stamspåret på den nedre delen av influensavirusets huvudhöljeprotein hemagglutinin. Den molekylära strukturen på denna plats tenderar inte att variera mycket mellan influensastammar eftersom den spelar en avgörande roll i en formförändringsprocess som tillåter viruset att penetrera värdcellen och initiera infektion. Strukturella utvärderingar av Kadam fann att peptiderna förhindrar denna formförändring och förhindrar därmed penetration av värdceller.
"En terapi som riktar sig till det första infektionsskedet skulle komplettera de befintliga anti-influensaläkemedel som riktar sig mot senare infektionsstadier, sa Kadam.
Peptiderna binder inte till sitt virala mål så omfattande som de antikroppar som de är baserade på. På grupp 2 influensa A-virus, till exempel, de saknade de skrymmande antikropparnas förmåga att skjuta åt sidan eller undvika en sockermolekyl på hemagglutininet som blockerar en viktig del av målstället. Dock, Kadam sa att ytterligare studier kan ge peptider med aktivitet mot både grupp 1 och grupp 2 influensa A och även influensa B stammar.
"Det är ganska revolutionerande att vi kunde använda strukturell information om antikroppar för att göra mycket mindre molekyler som har nästan samma bindningsaffinitet och neutraliseringsbredd mot influensavirus, sa Kadam.
"Det har funnits skepsis på området att vi skulle kunna få så bra resultat med så små molekyler, men den här studien visar att vi kan, " sa Wilson.