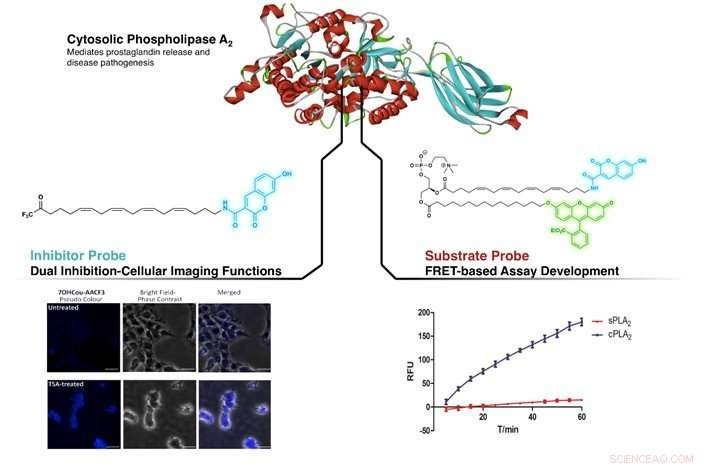
Figur visar inriktningen av cPLA2 av den nydesignade hämmaren och substratsonden. Vänster:Identifiera skillnader i cPLA2 -nivå i obehandlat och Trichostatin A (TSA, en inhibitorförening) -behandlade SHSY5Y-celler. Höger:Demonstrera högre selektivitet för cPLA2 mot sPLA2 (en annan medlem av fosfolipas A2-familjen) med FRET-baserad analys med hjälp av substratsonden. Upphovsman:NG Cheng Yang, CAO Xujun
NUS -kemister har nyligen utvecklat selektiva sonder för cytosoliskt fosfolipas A2 (cPLA2) för att bestämma enzymnivåer och aktivitet.
cPLA2 är ett viktigt enzym som används kraftigt för att reglera inflammatoriska svar i kroppen. Det har fått ett betydande intresse medicinskt, med ökande kopplingar till dess engagemang i inflammatoriska och neurologiska sjukdomar som Alzheimers sjukdom och multipel skleros. Förmågan att avbilda och korrekt identifiera cPLA2 i biologiska system är viktig för att förstå de mekanistiska vägar som är involverade i dessa sjukdomar. Ett team som leds av prof LAM Yulin från kemiska institutionen, NUS har upptäckt några fluorescerande föreningar som kan bilda cPLA2. Dessa inkluderar en hämmare (förening som reducerar enzymaktiviteten) och ett substrat (förening som enzymet verkar på) som uppvisar fluorescens.
Genom att efterlikna strukturen hos en välkänd hämmare av cPLA2, arakidonyltrifluormetylketon (AACOCF3), forskargruppen har framgångsrikt fäst ett fluorescerande organiskt färgämne (kumarin) på kolkedjan på AACOCF3. Detta skapade en fluorogen form av AACOCF3 som behöll sin nativa inhiberande aktivitet mot cPLA2. Preliminära studier utförda på den nydesignade föreningen visade dess förmåga att skilja mellan celler som innehåller olika nivåer av cPLA2. Samtidigt, denna nyutvecklade sond kunde hämma cPLA2, tillhandahåller en dubbel roll av avbildning och hämning. Detta gör att biokemister direkt kan upptäcka enzymet på cellnivå samtidigt som det påverkar ett avsett biologiskt svar.
Uppmuntras av dessa resultat, forskargruppen utökade sina studier genom att utveckla en annan sond för att mäta cPLA2 -aktivitet. Den konventionella analysen av cPLA2 -aktivitet använder en radioaktiv förening som ett substrat. Dock, användningen av sådana analyser är mycket oönskad på grund av farorna kring radioaktiva material. För att kringgå detta problem, olika kalorimetriska och fluorogena analyssatser för mätning av cPLA2 -aktivitet är nu kommersiellt tillgängliga. Dock, dessa analyser kan också detektera andra enzymer i PLA2 -familjen och är inte selektiva endast för cPLA2. Det skulle vara bra att ha en alternativ sond, som är specifikt inriktad på cPLA2.
Genom att anta ett liknande tillvägagångssätt, fluorogena kumarin- och fluorescein (ett annat fluorescerande organiskt färgämne) enheter fästes på fosfatidylkolin (ett substrat av cPLA2). Detta orsakar en icke-strålande intern överföring av energi mellan ett färgämne till det andra när den ljuskänsliga delen bestrålas vid dess excitationsvåglängd; ett fenomen som kallas Förster resonance energy transfer (FRET). Denna nya substratsond befanns vara mycket selektiv för cPLA2, utan förlust av nativ aktivitet och lämplig för inhibitor -screeninganalyser.
Gruppen undersöker för närvarande effekterna av att fästa fluorescerande kemiska föreningar med olika färger på både hämmaren och substratproberna för att vidga sina applikationer.