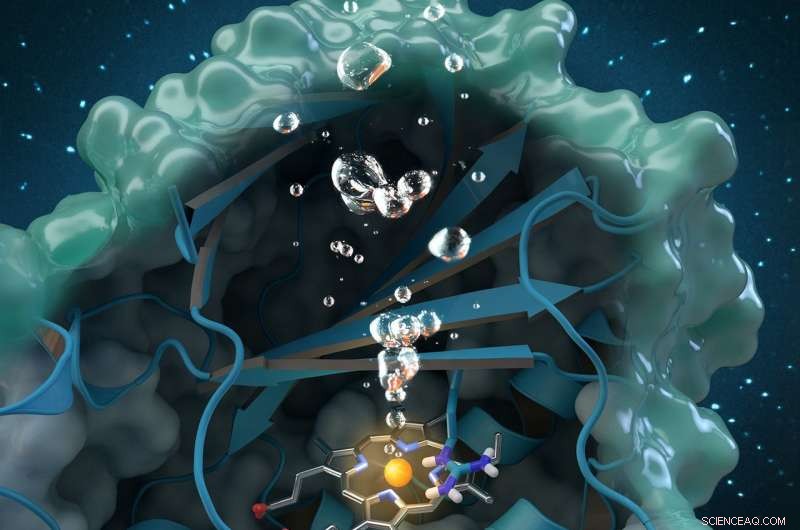
Kloritdismutas är ett unikt syregenererande enzym som bryter ned klorit, en industriell förorening som finns globalt i grundvatten, dricksvatten och jordar. Forskning utförd vid ORNL bidrar till en omfattande strukturell och biokemisk analys av enzymet, bana väg för framtida miljötillämpningar. Kredit:Tidskriftsomslag återtryckt med tillstånd från ACS-katalys , vol. 7, nummer 11, 3 november, 2017.
En ny studie belyser ett unikt enzym som kan ge en miljövänlig behandling av kloritförorenade vattenförsörjningar och förbättra vattenkvaliteten över hela världen.
Ett internationellt team av forskare under ledning av Christian Obinger från universitetet i Wien använde neutronanalys vid Oak Ridge National Laboratory, röntgenkristallografi och andra tekniker för att studera kloritdismutasenzymet. Detta naturligt förekommande protein kan bryta ner klorit, en industriell förorening som finns i grundvattnet, dricksvatten och jordar, till ofarliga biprodukter, men dess katalytiska process är inte väl förstådd. Att förstå hur det bakteriella enzymet omvandlar klorit till klorid och syre kan öppna möjligheter för framtida tillämpningar inom biosanering och bioteknik.
Resultaten, publiceras i ACS-katalys , också bidra till grundforskning om enzymets förmåga att producera syre. Syrebildning är otroligt sällsynt i naturen, en gång troddes endast möjlig genom fotosyntes, så den enzymatiska aktiviteten av kloritdismutas har väckt intresse från forskarsamhället bortom dess miljötillämpningar för rent vatten.
Exakt hur kloritdismutas fungerar på molekylär nivå för att bryta ner klorit har diskuterats sedan enzymet upptäcktes 1996. Komplexiteten i enzymets molekylära struktur och svårigheten att studera proteiner med experimentella metoder innebär inneboende utmaningar för forskare.
Som de flesta enzymer, kloritdismutas är ett protein som katalyserar en mycket specifik reaktion. Processen är ofta miljöberoende, vilket betyder att det fungerar bäst inom specifika parametrar, inklusive temperatur, koncentration och pH-intervall. Att identifiera de ideala parametrarna för reaktionen är nyckeln till att stödja bioteknik och storskalig produktion av kloritdismutas för att säkert avlägsna klorit från miljön och potentiellt utnyttja enzymets syregenerering.
Teamet isolerade en ostuderad Cyanothece-stam av kloritdismutas och undersökte proteinets kristallstruktur vid specifika pH-värden för att bestämma inverkan av pH på kloritomvandlingen.
Forskarna använde MaNDi, den makromolekylära neutrondiffraktometern, strållinje 11-B vid spallationsneutronkällan, en Department of Energy User Facility på ORNL, att samla in unika data som endast kan erhållas genom användning av neutroner.
"Olika proteinkristaller har olika grader av symmetri, som kommer att avgöra hur vi går tillväga för att mäta dem. Denna kristall är ovanlig eftersom den har väldigt lite symmetri, så ett särskilt stort antal reflektioner måste registreras individuellt för att få en komplett datamängd, " sa Leighton Coates, ManDi Lead Instrument Scientist. "Det här skulle vara en utmanande och långvarig uppgift var som helst, och det var endast möjligt inom denna tidsram på grund av den stora detektortäckningen för MaNDi-instrumentet."
På MaNDi, forskare kunde detektera protonationstillstånden för viktiga aminosyror som troddes stödja reaktionen. "Protonering" hänvisar till ett grundläggande steg i katalys under vilket väte fäster till molekyler. "Detta är den viktiga regionen av proteinet, där kemin sker och kloriten bryts ner, sa Coates.
Protonationstillstånd är inte lätta att observera eftersom de involverar väte, som är svår att upptäcka med röntgen eller andra tekniker. Dessutom, ett fenomen som kallas "fotoreduktion" uppstår när metallinnehållande enzymer som kloritdismutas utsätts för röntgenstrålar, väsentligen förändrar provets atomära struktur.
Eftersom neutrontekniker inte har dessa begränsningar, de kan ge forskare nyckelinformation som inte kan erhållas med andra metoder. "Neutroner är oförstörande och känsliga för lätta element som väte, så att de kan ge exklusiv information om atomstrukturen hos proteiner, som till stor del består av vätemolekyler, " förklarade Coates.
"Och till skillnad från röntgenstrålar som kan skada känsliga proteiner, neutrontekniker låter dig samla in data vid rumstemperatur på ett oförändrat protein i dess aktiva tillstånd utan påverkan av joniserande strålning och fotoreduktion, ", sa Coates. "Detta experiment belyser verkligen fördelen med att använda neutroner för att studera proteiner."