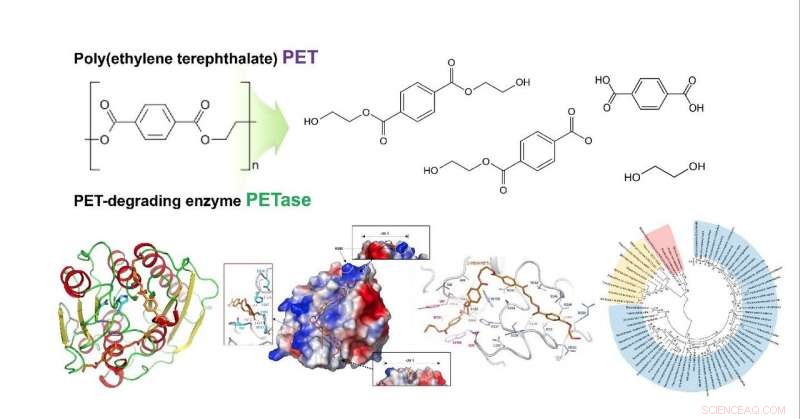
Strukturell insikt i den molekylära mekanismen för nedbrytning av poly (etylentereftalat) och det fylogenetiska trädet av möjliga PET -nedbrytande enzymer. Upphovsman:KAIST
Ett KAIST -ämnesomsättningsteam har funnit en molekylär mekanism som visar överlägsen nedbrytbarhet av polyetentereftalat (PET). Detta är den första rapporten för att bestämma 3D-kristallstrukturen för Ideonella sakaiensis PETase och utveckla den nya varianten med förbättrad PET-nedbrytning.
Forskningsprojekt har arbetat för att hantera materialets nedbrytbarhet. En polyetentereftalat (PET) -nedbrytande bakterie som heter Ideonella sakaiensis identifierades nyligen för eventuell nedbrytning och återvinning av PET av ett japanskt team som publicerade resultat i Vetenskap 2016. Dock den detaljerade molekylära mekanismen för PET -nedbrytning bestämdes inte.
Teamet under ledning av professor Sang Yup Lee vid Institutionen för kemisk och biomolekylär teknik och ett annat team som leddes av professor Kyung-Jin Kim vid Institutionen för bioteknik vid Kyungpook National University genomförde denna forskning. Resultaten publicerades i Naturkommunikation den 26 januari.
Denna forskning förutspår en speciell molekylär mekanism baserad på dockningsimuleringen mellan PETase och ett PET -alternativ som efterliknar substrat. De konstruerade varianten för IsPETase med förbättrad PET-nedbrytande aktivitet med strukturbaserad proteinteknik.
Det förväntas att de nya tillvägagångssätten i denna forskning kan bidra till ytterligare studier av andra enzymer som kan förstöra inte bara PET utan annan plast, också.
Efter användning, PET orsakar miljöföroreningar på grund av dess icke-biologiska nedbrytbarhet. Konventionellt, PET slängs på deponier, med förbränning, och ibland återvinning med kemiska metoder, vilket orsakar ytterligare miljöföroreningar. Därför, högeffektiva PET-nedbrytande enzymer och biobaserade, miljövänliga metoder är önskvärda.
Nyligen, forskare isolerade en ny bakterieart, Ideonella sakaiensis, som kan använda PET som kolkälla. PETas av I. sakaiensis (IsPETase) kan bryta ned PET med relativt högre framgång än andra PET-nedbrytande enzymer. Dock, den detaljerade enzymmekanismen har inte klarlagts, hindrar ytterligare studier.
Forskargrupperna undersökte hur substratet binder till enzymet och vilka skillnader i enzymstruktur som resulterar i betydligt högre PET -nedbrytande aktivitet jämfört med andra cutinaser och esteraser. Baserat på 3D-strukturen och relaterade biokemiska studier, de bestämde framgångsrikt grunden för PET -nedbrytande aktivitet hos IsPETase och föreslog andra enzymer som kan bryta ned PET med ett nytt fylogenetiskt träd. Teamet föreslog att 4 MHET-grupper är de mest korrekt matchade substraten på grund av en strukturell klyfta även med 10-20-mers för PET. Detta är meningsfullt eftersom det är den första dockningsimuleringen mellan PETase och PET, inte dess monomer.
Vidare, de lyckades utveckla en ny variant med mycket högre PET-nedbrytande aktivitet med hjälp av en kristallstruktur av denna variant för att visa att den förändrade strukturen bättre rymmer PET-substrat än vildtyp PETas, vilket kommer att leda till överlägsen enzymutveckling och plattformskonstruktion för mikrobiell plaståtervinning.
Professor Lee sa, "Miljöföroreningar från plast är fortfarande en av de största utmaningarna världen över med den ökande plastförbrukningen. Vi konstruerade framgångsrikt en ny, överlägsen PET-nedbrytande variant med bestämning av en kristallstruktur av PETase och dess nedbrytande molekylära mekanism. Denna nya teknik kommer att hjälpa ytterligare studier för att konstruera mer överlägsna enzymer med hög effektivitet vid nedbrytning. "