Kredit:Japan Science and Technology Agency (JST)
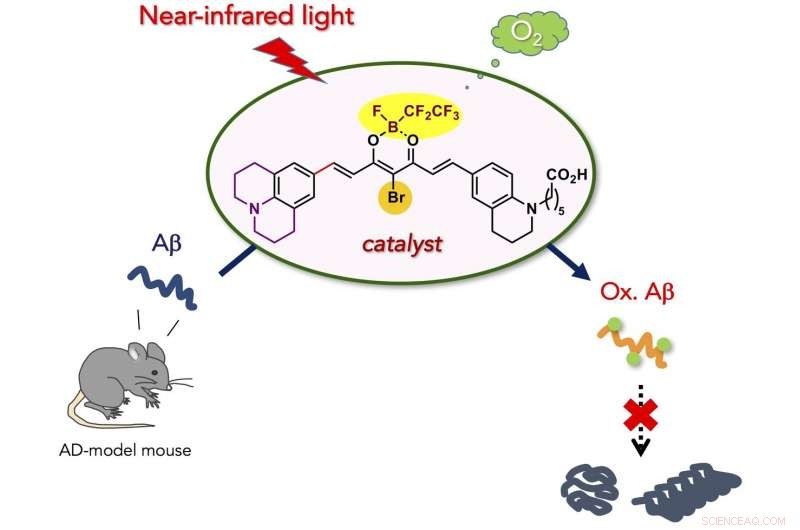
En ny, biokompatibel fotooxygeneringskatalysator som selektivt kan syresätta och bryta ned den patogena aggregationen av Alzheimers sjukdom (AD)-relaterad amyloid-β-peptid (Aβ) under nära-infraröd (NIR) ljusbestrålning har utvecklats. Katalysatorn kunde syresätta Aβ inbäddad under huden på en levande mus, och minskad intakt Ap-nivå i AD-modell mushjärna. Den nya katalysatorn är potentiellt användbar för behandling av perifera amyloidsjukdomar och AD.
Toxisk aggregation av amyloidpeptid och protein är intimt relaterat till ett antal mänskliga sjukdomar. Amyloid-β (Aβ) är en representativ amyloidpeptid vars aggregation är relaterad till patogenesen av Alzheimers sjukdom (AD). Utvecklingen av ett artificiellt kemiskt system som selektivt omvandlar giftiga amyloidaggregat till giftfria arter under fysiologiska förhållanden, därigenom potentiellt undertrycka den patogena processen, kan vara en ny terapeutisk strategi för att behandla för närvarande obotliga amyloidsjukdomar, inklusive AD.
Forskarna föreställde sig att fotokatalyserad aerob syresättning skulle vara en lämplig kemisk reaktion för att försvaga de patogena aggregativa egenskaperna hos Aβ under fysiologiska förhållanden. Eftersom peptid- och proteinaggregation i allmänhet beror på intermolekylära hydrofoba interaktioner, kovalent installation av hydrofila syreatomer till en peptid eller ett protein (dvs. syresättning) skulle minska den aggregativa egenskapen. Vi har tidigare rapporterat att aerob syresättning av Aβ fortsätter i närvaro av Flavin (vitamin B2)-baserade fotokatalysatorer, och den resulterande syresatta Ap uppvisar mycket låg aggregativ förmåga och toxicitet. Därefter, mer selektiva fotooxygeneringskatalysatorer, aktiveras endast när man känner av en giftig amyloidstruktur av högre ordning, utvecklades baserat på en fluorescensprob för aggregerad amyloidpeptid och protein. In vivo applicering av katalysatorerna var, dock, omöjligt, eftersom bestrålning med synligt ljus, som har låg vävnadspenetration, var nödvändig för katalysator -excitation. För in vivo-applikation, fotokatalysatorer måste kunna fungera under excitation med ljus med längre våglängder, kallas det "optiska fönstret" där levande vävnad absorberar relativt lite ljus.
Här, vi utvecklade biokompatibel fotooxygeneringskatalysator som selektivt kan syresätta och bryta ned den patogena aggregationen av Aβ under nära-infraröd (NIR) ljusbestrålning. Katalysatorn uppvisade fyra huvudsakliga fördelar jämfört med de tidigare katalysatorerna för nedbrytning av aggregerad och giftig Aβ:(1) Hög selektivitet för aggregerad Aβ som härrör från den högre ordningens amyloidstruktur-avkännande på/av-brytaren för katalysatoraktiviteten. Den exakta målselektiviteten möjliggjorde fotooxygenering av aggregerad Ap i närvaro av cellerna och i mushjärnlysat. (2) Låg toxicitet för cellerna. Strukturell optimering av katalysatorn minskade markant cytotoxiciteten, både i mörker och under NIR-bestrålning. (3) Hög syresättningseffekt under NIR -fotobestrålning. På grund av vävnadspermeabilitet för NIR-ljus, fotooxygenering av aggregerad Ap under mushuden var möjlig i högt utbyte. (4) Tillämpbarhet på den levande djurhjärnan in vivo. Injektion av katalysatorn till AD-modellens mushjärna tillsammans med NIR-ljusbestrålning ledde till signifikant minskning av den intakta Ap-nivån i hjärnan. Resultaten som erhållits i denna studie är ett viktigt steg för att använda artificiell katalys som en potentiell terapeutisk strategi mot amyloidsjukdomar.