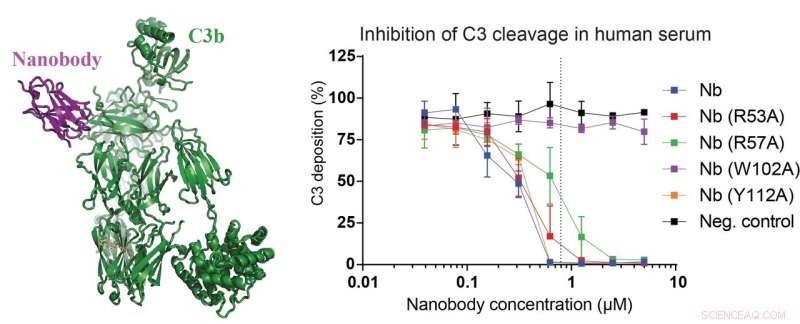
Vänster panel i figuren visar strukturen av den nyutvecklade nanokroppen (magenta) bunden till ett C3-fragment som kallas C3b (grönt). I de högra panelerna, data som visar att nanokroppen och mutanter härav kan hämma klyvningen av C3 i 15 procent humant serum. Forskarna konstruerade också en nanobody-mutant som helt förlorar sin hämmande effekt på C3-klyvning (lila kurva) vilket gör den till en perfekt negativ kontroll. Upphovsman:Rasmus Kjeldsen Jensen och Janus Asbjørn Schatz-Jakobsen, Århus universitet
Forskare från Institutionen för molekylärbiologi och genetik och från Institutionen för biomedicin vid Aarhus Universitet har i samarbete utvecklat och beskrivit en lamaantikropp som kan ha betydande inverkan för framtida diagnostik och behandling av, t.ex., njursjukdomar.
Forskargruppen studerade ett protein som heter C3 från den del av det medfödda immunsystemet som kallas komplementsystemet. Vid erkännande av patogena organismer eller döende kroppsceller, C3 klyvs av blodenzymer som en del av en försvarsmekanism. Dessa enzymer är kända som C3-konvertaser, och klyvningen av C3 resulterar i två fragment. Fragmentet som kallas 3b binder direkt till patogenerna, medan det andra fragmentet rekryterar och stimulerar immunceller att eliminera målet.
I en frisk person, celler skyddas mot effekterna av C3-klyvningen. Dock, som ett resultat av mutationer i DNA, detta skydd kan gå förlorat, öka risken för att utveckla kroniska inflammatoriska sjukdomar eller autoimmuna sjukdomar. Under en lång tid, forskarna har fokuserat på att utveckla medel som förhindrar sådan oönskad komplementaktivering. Av denna anledning, de utvecklade lama -antikroppen för att förhindra klyvning av C3. Lamaantikroppar är också kända som nanokroppar på grund av sin lilla storlek, och jämfört med normala antikroppar, de är lätta att utveckla och betydligt billigare att producera.
"Tekniken som används för att utveckla och producera dessa nanokroppar har varit känd i mer än två decennier, " säger Gregers Rom Andersen. "Och därför, det är något förvånande att vi är först i världen med att utveckla en nanobody som hämmar komplementsystemet."
Genom att exponera kristaller för röntgenstrålar och korrelera resultaten med data från elektronmikroskopi, forskarna har beskrivit hur deras nanokropp binder C3 i stora detaljer.
"Kristallstrukturen hos vår nanokropp bunden till C3 stödjer våra tidigare föreslagna modeller som beskriver hur komplementkonvertaserna känner igen sina substrat och förklarar därför tydligt varför vår nanokropp utövar sin hämmande effekt på klyvningen av C3. Våra resultat förbättrar också den grundläggande förståelsen för hur detta väsentlig mekanism inom komplementsystemet fungerar. Genom att jämföra med tidigare publicerade proteinstrukturer, vi kan dessutom förklara varför vår nanokropp hämmar bildandet av C3-konvertaserna, vår nanobody har en "dubbel hämmande" effekt så att säga, ”förklarar Rasmus Kjeldsen Jensen.
Förutom arbetet som beskriver C3-nanobody-komplexet, forskargruppen har också utfört flera laboratorieexperiment med serum från både möss och människor. Dessa resultat bekräftar observationerna från atomstrukturen och avslöjar tydligt att deras nyutvecklade nanokropp hämmar klyvningen av C3 i både humant och murint serum. Det senare är viktigt, eftersom möss ofta används som sjukdomsmodeller.
"Våra serumförsök är viktiga eftersom de visar att vår nanokropp faktiskt fungerar under fysiologiska förhållanden, där komplementsystemet naturligt utövar sin funktion. Dessa resultat indikerar att vår nanobody skulle kunna användas vid behandling av sjukdomar orsakade av överaktivering av komplementsystemet. Som ett exempel, en del av njuren är inte skyddad mot komplement i samma grad som andra vävnader, och i det här fallet kan vår nanobody vara en kandidat för att stoppa komplementdriven sjukdomsprogression, " säger Gregers Rom Andersen. "Men, vi fann också att vår nanokropp kan hämma de skyddande effekter som vår egen kropp normalt utövar mot komplement, och man bör därför vara mycket försiktig och noggrant utvärdera de möjliga biverkningarna av terapeutisk behandling av sjukdomar med vår nanokropp, avslutar Gregers Rom Andersen.
Grunden för detta arbete etablerades av de två biträdande professorerna Kasper Røjkjær Andersen och Nick Stub Laursen från institutionen för molekylärbiologi och genetik, som var först i Danmark med att systematiskt utveckla och producera storskaliga nanokroppar. Dock, drivkraften i projektet var doktoranden Rasmus Kjeldsen Jensen under ledning av professor Gregers Rom Andersen, som i karaktäriseringen av nanobodyn fick hjälp av de två doktoranderna Trine Amalie Fogh Gadeberg och Rasmus Pihl.