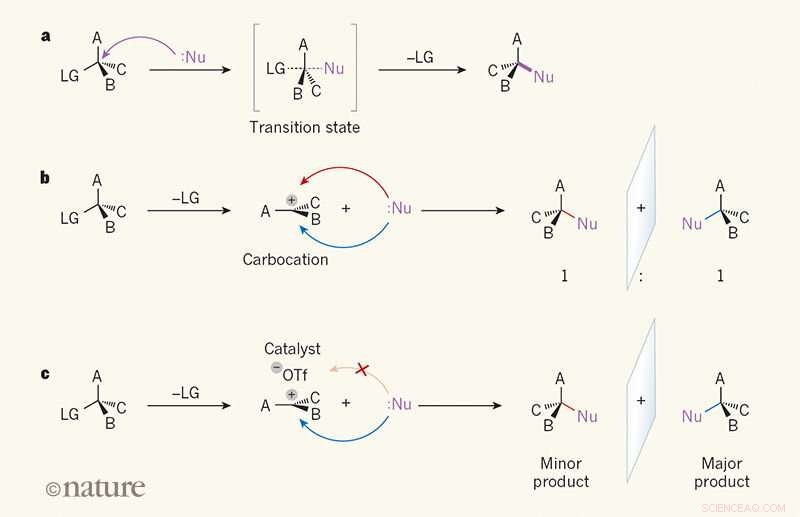
Spegelbildselektivitet i substitutionsreaktioner. a, I en SN2-reaktion, en reaktant som kallas en nukleofil (Nu; prickar indikerar ett ensamt elektronpar) angriper en kolatom i en organisk molekyl från den sida som är motsatt en "avgående" grupp (LG). A, B och C kan vara vilken atom eller grupp som helst. I övergångsläget, bindningen mellan kolatomen och LG är delvis bruten, och en bindning mellan Nu och kolatomen bildas delvis (delvis brutna och delvis bildade bindningar visas som streckade linjer). Bandet till LG bryts sedan, och en enda produkt bildas. b, I SN1-reaktionen, LG släpps först, och en plan, laddad intermediär som kallas en karbocation bildas. Eftersom Nu kan attackera kolsyran lika lätt från båda sidor, produkten bildas som ett 1:1-förhållande av spegelbildisomerer (enantiomerer). c, Wendlandt et al.1 rapporterar en SN1-reaktion där en småmolekylär katalysator och en triflatjon (–OTf) binder till ena sidan av karbokaten, styr nukleofilen till andra sidan. En enantiomer produceras därför företrädesvis. Kreditera: Natur (2018). DOI:10.1038/s41586-018-0042-1
Ett team av forskare vid Harvard University i USA har utvecklat ett sätt för oss att en SN1-reaktion för att göra kvartära kolstereocenter. I deras papper publicerad i tidskriften Natur , teamet beskriver att övervinna tendensen hos SN1-reaktioner att förstöra stereokemi för att göra det kolcentrerade materialet. Tobias Morack och Ryan Gilmour från universitetet i Münster i Tyskland, erbjuda en News &Views-artikel om studien i samma tidskriftsnummer.
Som forskarna noterar, ända tills nu, det har inte funnits någon bra metod för att göra kvartära stereocenter. Nuvarande metoder, de noterar, tenderar att baseras på pro-kirala substrat, som i sig är en utmaning att göra. I denna nya ansträngning, teamet vid Harvard kom på ett nytt tillvägagångssätt – en baserad på SN1-reaktionen.
SN1-reaktioner är en stöttepelare i inledande kurser i organisk kemi, men de orsakar notoriskt förödelse med stereokemi. Trots det, forskarna trodde att de kunde använda den platta karbocation-mellanprodukten som produceras i sådana reaktioner som ett substrat. För detta ändamål, de kom fram till en SN1-reaktion som omvandlade en blandning av propargylacetat (med lika mängder vänster- och högerhänta enantiomerer - en racemisk) till en blandning med ett kvartärt centrum. En vätebindningsdonator användes som en katalysator för att avlägsna acetoximaterialen som ersattes med en allylblandning - resultatet blev en enda enantiomer.
Slutprodukterna var intressanta, Morack och Gilmour noterar, eftersom kolstereocentren hade ett brett utbud av elektronorbitaler. Det betyder att de har olika fysiska geometrier och därmed reagerar olika. Detta öppnar upp för att använda dem för att producera en mängd olika molekyler som kan användas i olika reaktioner för att syntetisera nya kemikalier.
Forskarna noterar att de inte är klara med arbetet – de planerar att prova samma tillvägagångssätt med föreningar som inte är lika stabila. Gör så, de erkänner, kommer att kräva användning av en katalysator som är ännu mer reaktiv. De planerar också att undersöka att genomföra reaktionen med olika nukleofiler.
© 2018 Phys.org