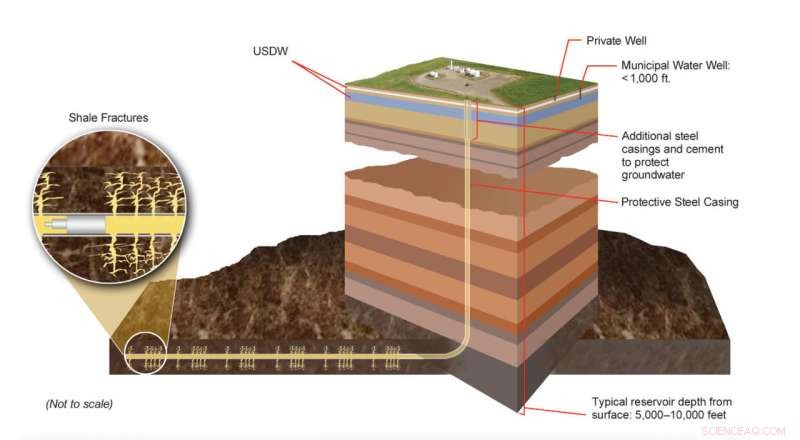
Producerbara delar av skiffergasformationer är belägna många tusen fot under landytan, långt under underjordiska källor för dricksvatten (USDW). Modern hydraulisk sprickteknik involverar sofistikerade ingenjörsprocesser utformade för att skapa distinkta spricknätverk i specifika berglager. Experter övervakar kontinuerligt dessa processer för att säkerställa att de följer lokala, stat, och federala lagar och förordningar. Kredit:U.S. DOE
Tänk om en stor värmefångande växthusgas kunde förbrukas för att producera en värdefull kemikalie som är en bristvara? Kemister vid det amerikanska energidepartementets (DOE) Brookhaven National Laboratory har identifierat en katalysator – ett ämne som påskyndar en kemisk reaktion – som kanske kan göra just det. Denna "bimetalliska" katalysator, gjord av järn och nickel, driver reaktionen mellan växthusgasen koldioxid och den energirika gasen propan för att producera propen. Propylen är en kemisk byggsten som används vid tillverkning av många vardagliga föremål, inklusive batterier, bildelar, och kläder och andra textilier.
Propenproduktionsgapet
Historiskt sett, propen har varit en biprodukt av ångkrackning - en process där ett råmaterial (råvara) blandas med ånga och värms upp till cirka 1500 grader Fahrenheit inuti massiva ugnar som "spricker" isär molekylära bindningar - för att producera eten, föregångaren till de flesta av världens plaster. Dock, propen samproduceras inte längre i de kvantiteter som behövs för att hålla jämna steg med efterfrågan. Under det senaste decenniet, skiffergas, eller naturgas från finkorniga sedimentära bergarter, har blivit mycket billigt i USA på grund av tekniska framsteg inom fracking. Skiffergas består till största delen av metan men innehåller även fraktioner av etan och propan. Industrin har utnyttjat detta överflöd av lågprisetan i råvaror för etenproduktion, men till bekostnad av propenproduktion.
"Mängden propen som samproduceras beror på vilken typ av råmaterial som används, och etanångkrackning är mycket selektivt mot eten, sa Jingguang Chen, som innehar gemensamma utnämningar som senior kemist vid Brookhaven Lab och som Thayer Lindsley professor i kemiteknik vid Columbia University. "Teknik som specifikt inriktar sig på propenproduktion behövs för att fylla tomrummet för denna viktiga kemikalie."
En av de befintliga teknologierna är propandehydrering, där två väteatomer avlägsnas från propan (C3H8) för att göra propen (C3H6). Men denna process är mycket energikrävande på grund av de höga temperaturer som krävs för att erhålla betydande propenutbyten. Även om tillsats av syre till propaninmatningen minskar mängden energi som krävs, i närvaro av överskott av syre, propan brinner och bildar vatten och koldioxid.
En ny väg för produktion av propen
I den här studien, forskarna hittade ett mer miljö- och energivänligt tillvägagångssätt genom att introducera koldioxid som en reaktant, istället för en produkt.
"Koldioxid fungerar som oxidant, reagerar med propan för att producera propen, vatten, och kolmonoxid, sa Elaine Gomez, en Ph.D. kandidat i kemiteknik vid Columbia University och medlem av Chens forskargrupp. Gomez är den första författaren på en nyligen publicerad Naturkommunikation artikel som beskriver arbetet.
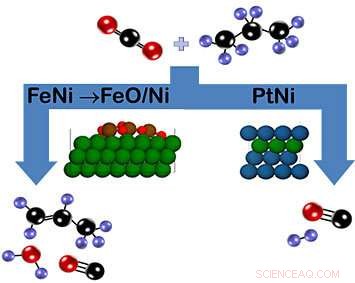
Som visas i schemat, koldioxid och propan kan reagera på järn-nickel (FeNi) katalysatorn för att bilda propen (vänster) eller på platina-nickel (PtNi) katalysatorn för att bilda syngas (höger). När det gäller FeNi, ett oxidskikt av FeO/Ni som bildas under reaktionen uppmuntrar brytning av C-H-bindningen. Däremot PtNi-katalysatorn har ingen oxidfas. Färgnyckel:kol =svart, syre =röd, väte =lila, nickel =grön, järn =brun, platina =blå). Kredit:Brookhaven National Laboratory
För att denna reaktion ska fortsätta, forskarna var tvungna att designa en katalysator som kunde utföra två funktioner:aktivera koldioxid (en mycket stabil molekyl) och bryta en kol-vätebindning (C-H).
"Grunden för vår katalysator är ceriumoxid, eller ceriumoxid, som aktiverar koldioxid genom att fritt utbyta syre, " förklarade Gomez. "Utöver det stödet, vi lägger till metallerna järn och nickel, som kan bryta CH-bindningen."
På grundval av tidigare arbete utfört av Chens grupp, laget hade en aning om vilken katalysator de skulle välja. Använda beräkningsresurser vid Brookhaven Labs Center for Functional Nanomaterials och Lawrence Berkeleys National Energy Research Scientific Computing Center (båda DOE Office of Science User Facilities), Brookhaven-kemisten Ping Liu och forskarassistenten Shyam Kattel beräknade mängden energi som krävs för att olika steg i den katalytiska reaktionen ska fortsätta. Deras beräkningar baserades på röntgenabsorptionsspektroskopistudier som Gomez och medförfattarna Bingham Yan och Siyu Yao från Brookhavens kemiavdelning utförde vid Stanford Synchrotron Radiation Lightsource vid SLAC National Accelerator Laboratory och Advanced Photon Source vid Argonne National Lab (även DOE) Office of Science User Facilities) för att identifiera strukturen och sammansättningen av katalysatorns aktiva platser under reaktionsförhållanden. De resulterande spektra avslöjade att ytan på järn-nickel-katalysatorn oxideras under reaktionen, och beräkningarna visade att detta gränssnitt mellan järnoxid och nickel uppmuntrar brytningen av CH-bindningen.
"En beräkningsmetod som kallas densitetsfunktionsteori [DFT] tillåter oss att beräkna termodynamiken och kinetiken för reaktionsvägen med en given katalysator för att avgöra om C-H-bindningsbrytning är energetiskt gynnsam, ", sa Kattel. "DFT förutspår att den järn- och nickelbaserade katalysatorn är en bra kandidat."
Gomez bekräftade denna förutsägelse genom flödesreaktorstudier, i vilken de olika reaktantgaserna matas från lagringstankar till en enda ledning som ansluter till en U-formad glasrörsreaktor. Gasblandningen strömmar i ena änden av röret och reagerar med den pulverformiga katalysatorn (vid den temperatur som katalysatorn är aktiv - i detta fall, runt 1000 grader Fahrenheit) packad i rörets andra ände. När produkterna dyker upp, en separationsteknik som kallas gaskromatografi kan användas för att identifiera typen och mängden av närvarande kemikalier. Genom att jämföra mängden reaktanter som konsumeras och tillverkade produkter, forskare kan bestämma katalysatorns selektivitet mot den önskade produkten. I detta experiment, selektiviteten var mer än 50 procent för omvandling av propan till propen.
Använder samma ceriumoxidstöd men ersätter järn med platina, forskarna främjade en annan reaktionsväg där kol-kolbindningar bryts för att producera kolmonoxid och väte - en kombination som kallas syntesgas (syngas), en mellanprodukt för produktion av ammoniak, metanol, och andra kemikalier.
"Båda katalysatorerna är aktiva vid samma temperatur, men genom att justera deras kemiska sammansättning, vi kan styra reaktionen för att producera propen eller syngas, " sa Chen.
"Vi planerar att använda vår nuvarande djupa förståelse av reaktionsmekanismen för att ytterligare förbättra omvandlingen av propan till propen, ", sa Liu. "Denna förståelse möjliggör en rationell screening av katalysatorer på en teoretisk nivå, och de lovande kandidaterna kommer att syntetiseras och testas experimentellt."
"Vi hoppas att industrin och akademin kommer att överväga vår nya väg, som förbrukar en växthusgas och kräver mindre energi än traditionella propenproduktionsmetoder, ", sa Gomez. "Att översätta vår upptäckt till en kommersialiserad teknologi kan hjälpa till att möta den globala efterfrågan på denna högvärdiga kemikalie."