
Experimentet utfördes med instrumentet Coherent X-ray Imaging (CXI), som använder sig av den snabba, lysande röntgenpulser från Linac Coherent Light Source. CXI tillämpar metoden "diffraktion-före-destruktion" för att göra mätningar med ultrakorta röntgenpulser innan de skadar sina mål. Kredit:SLAC National Accelerator Laboratory
Tuberkulos, en lungsjukdom som sprider sig i luften genom hosta eller nysningar, dödar nu fler människor över hela världen än något annat smittämne, enligt Världshälsoorganisationens senaste globala tuberkulosrapport. Och i hundratusentals fall varje år, behandlingen misslyckas eftersom bakterierna som orsakar Tb har blivit resistenta mot antibiotika.
Nu har ett internationellt team av forskare hittat ett nytt sätt att undersöka hur Tb-bakterier inaktiverar en viktig familj av antibiotika:De såg processen i aktion för första gången med en röntgenfri elektronlaser, eller XFEL.
I experiment vid Department of Energys SLAC National Accelerator Laboratory, de blandade ett antibiotikum med ett enzym som heter beta-laktamas som Tb-bakterier använder, och såg sedan i realtid när enzymet attackerade antibiotikumet för att inaktivera det.
Forskarnas metod, kallas blanda-och-injicera seriell kristallografi, utnyttjar det lysande, ultrasnabba pulser producerade av SLAC:s Linac Coherent Light Source (LCLS). Röntgenbilder tagna 30 millisekunder till 2 sekunder efter att reaktionen började visade att laktamas binder till antibiotikan, ceftriaxon, och spränger en av dess kemiska bindningar.
Resultaten av experimentet publicerades idag i BMC Biologi .
"Denna proof-of-concept-studie visar att vi kan se formen och mellanstadierna av molekylerna under processen, säger Marius Schmidt, en professor vid University of Wisconsin Milwaukee som ledde experimentet. "Efter decennier av att pröva andra tekniker inom kristallografiområdet, tekniken är här."
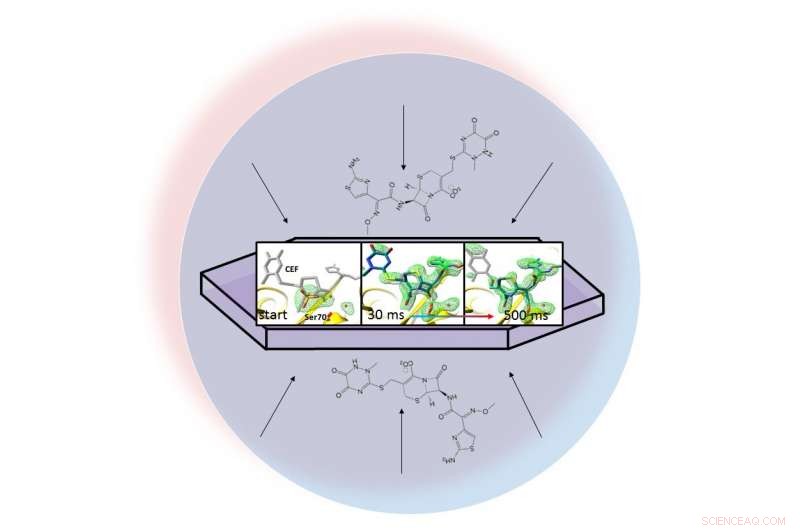
I en vätskedroppe (representerad av den ljusblå cirkeln), ett antibiotikum sprids genom ett kristalliserat protein, beta-laktamas, och binder till det. Röntgenbilder av det bundna paret gjorde det möjligt för forskare att skapa kartor över elektrontätheten (grön) och se hur en ring i antibiotikan bryts upp (längst till höger) 30 till 500 millisekunder efter att reaktionen började. Kredit:Marius Schmidt / University of Wisconsin Milwaukee
I kristallografi, forskare bildar en kristall av många kopior av ett protein och träffar kristallen med röntgenstrålar för att producera ett diffraktionsmönster på en detektor, som avslöjar proteinets atomstruktur. Denna struktur är nyckeln till att förstå hur enzymer och andra proteiner fungerar.
Tidigare fungerade detta bara med relativt stora kristaller, som har begränsat värde i denna metod eftersom lösningen som innehåller antibiotikumet skulle ta lång tid att diffundera in i kristallen och reagera med enzymet. Det är viktigt att diffusionen är snabbare än reaktionen, så att de många proteinmolekylerna i kristallen startar den kemiska processen tillsammans.
Men LCLS och andra XFELs har så intensiva strålar att de kan fånga diffraktionsmönster från mycket mindre kristaller, en miljondels meter i diameter eller mindre, Schmidt sa, så att antibiotikan snabbt kan komma till enzymet, och reaktionen kan registreras med röntgenstrålar.
"Medan det har gjorts eleganta studier för att observera proteinrörelser med ljusinducerade förändringar, vårt arbete visar att en större klass av proteiner, nämligen enzymer, kan undersökas på ett tidsbestämt sätt vid LCLS och andra XFELs, säger Jose Olmos, en doktorand vid Rice University som är en av publikationens huvudförfattare.
I den här studien, forskargruppen levererade små kristaller av beta-laktamas medan de blandades med antibiotikan bara bråkdelar av en sekund innan de träffades med röntgenpulser.
Kredit:CC0 Public Domain
Teamet tog miljontals röntgenbilder under reaktionen och satte ihop dem för att skapa en karta som visar förändringar i antibiotikumets tredimensionella struktur när det interagerar med enzymet vid rumstemperatur.
"För strukturbiologer, det är så vi lär oss exakt hur biologi fungerar, " säger Mark Hunter, personalforskare vid SLAC och medförfattare till studien. "Vi dechiffrerar en molekyls struktur vid en viss tidpunkt, och det ger oss en bättre uppfattning om hur molekylen fungerar."
I framtida experiment, att ta ännu fler ögonblicksbilder under reaktionens gång kan ge mer detaljer om laktamasets struktur och kemiska beteende. Med mer information kan forskare manipulera utformningen av antibiotika för att förhindra sådana attacker. Den experimentella metoden kan också användas för att lära sig de fina detaljerna i andra typer av biologiska processer där enzymer initierar eller styr reaktioner.
"Det byggs en stor mängd spänning över den här metoden, eftersom det öppnar upp detta nya tidsrike för strukturbiologer, " säger Hunter. Tidigare arbete med denna teknik fångade vändningen av en RNA-switch, "viktigt för studier av retrovirus och cancer.
Forskarna planerar att använda metoden för att titta på ytterligare antibiotika. De avser också att dra fördel av högre upprepningsfrekvenser – snabbare avfyring av röntgenpulser – som förväntas vid en framtida uppgradering till LCLS och vid den nyligen öppnade europeiska XFEL. Detta gör det möjligt för forskare att fånga de data de behöver på bara några minuter, jämfört med dagar. De skulle också kunna ta ögonblicksbilder av reaktionerna på närmare avstånd, vilket skulle kunna ge en ännu mer komplett bild av den snabba kemin när den händer.