Upphovsman:Wiley
Några små celler som skiljer sig från resten kan ha stor effekt. Till exempel, individuella cancerceller kan vara resistenta mot en specifik kemoterapi – vilket orsakar ett återfall hos en patient som annars skulle bli botad. I journalen Angewandte Chemie , forskare har nu introducerat ett mikrofluidikbaserat chip för manipulation och efterföljande nukleinsyraanalys av enskilda celler. Tekniken använder lokala elektriska fält för att effektivt "fälla" cellerna (dielektrofores).
Molekylära analyser av enskilda celler är nödvändiga för att bättre förstå rollen av heterogena cellpopulationer i utvecklingen av sjukdomar och för att utveckla effektiva terapier för personlig medicin. Att identifiera enskilda celler i en massa andra celler är en enorm utmaning inom diagnostisk medicin. Cellerna måste sorteras, höll, överförd till en annan behållare med en extremt liten volym ( <1 μL) och måste sedan genomgå molekylär analys. Konventionella metoder är vanligtvis mycket tidskrävande och komplexa, samt opålitliga och ineffektiva. De kan också äventyra cellernas livsduglighet, kräver stora provvolymer, har hög risk för kontaminering, och/eller kräver dyra instrument.
Forskare från University of Washington (Seattle, USA), Iowa State University (Ames, USA), och Fred Hutchinson Cancer Research Center (Seattle, USA) har använt mikrofluidisk teknologi för att övervinna dessa problem. Alla nödvändiga steg sker tillförlitligt på ett speciellt utvecklat mikrochip med minimala mängder lösningsmedel och utan att cellerna behöver märkas. I motsats till konventionella mikrofluidiska chips, denna kräver varken komplex tillverkningsteknik eller komponenter som ventiler eller omrörare.
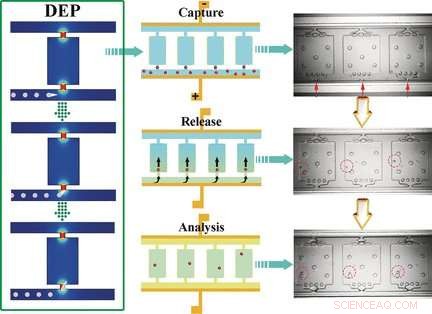
Self-Digitalization Dielectrophoretic (SD-DEP) -chipet är ungefär lika stort som ett mynt och har två parallella mikrokanaler (50 μm djupa x 35 μm breda x 3,2 cm långa) anslutna med många små små kammare. Mikrokanalernas öppningar är bara 15 μm breda. En tunn elektrod sträcks längs kanalernas längd. Kanalerna och kamrarna är fyllda med en buffert, en växelspänning appliceras, och provet läggs till en av mikrokanalerna. Teamet som leds av Robbyn K. Anand och Daniel T. Chiu använde leukemiceller i sina experiment.
Lokala maxima för det elektriska fältet inträffar vid de smala ingångarna till kamrarna. Celler som kommer in i kamrarna är "instängda". Eftersom ingångens dimensioner liknar den genomsnittliga storleken på en cell, endast en enda cell kan fångas av varje kammaringång. När växelströmmen är avstängd och flödeshastigheten ökas genom injektion av de reagenser som krävs för efterföljande analys, cellerna tvättas in i kamrarna. En olja tillsätts sedan för att täta kamrarna. Cellerna löses sedan upp, och nukleinsyrorna frigörs och multipliceras och kan identifieras som leukemiceller med en markörgen.
I framtida studier, forskarna hoppas kunna använda chippet för att fastställa fördelningen av genetiska mutationer som är relaterade till resistens i leukemiceller och som därmed kan orsaka återfall.