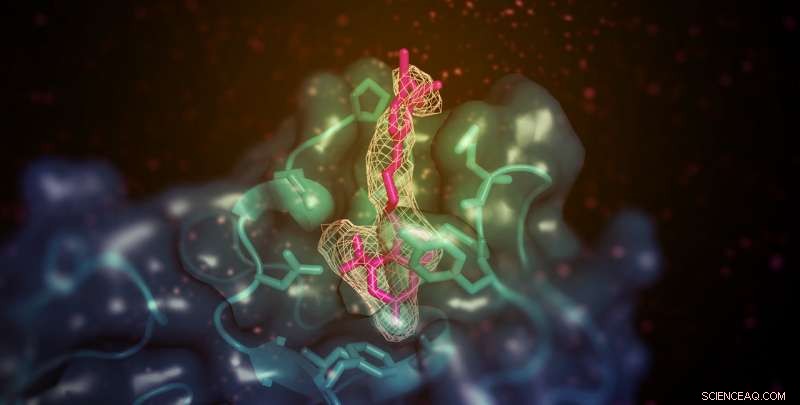
En liten molekyl (visas här i rosa) med förmågan att öka det "goda" (HDL) kolesterolet i djurmodeller binder till den membranbindande domänen av lecitin:kolesterolacyltransferas (LCAT; visat i kricka). Stället är avlägset från det aktiva stället för enzymet men möjliggör på något sätt överföring av lipidsubstrat från HDL. Kredit:Kelly Manthei och Stephanie King
Forskare har bestämt strukturen av den aktiverade formen av ett enzym som hjälper till att återföra överskott av kolesterol till levern, en studie i eLife rapporterar.
Forskningen visar hur en läkemedelsliknande kemikalie stimulerar verkan av enzymet lecitin:kolesterol acyltransferas (LCAT). Det tyder också på att framtida läkemedel som använder samma mekanism kan användas för att återställa LCAT-funktionen hos personer med familjär LCAT-brist (FLD), en sällsynt ärftlig sjukdom som utsätter dem för risk för ögonproblem, anemi och njursvikt.
LCAT hjälper högdensitetslipoprotein (HDL) - känt som det "goda" kolesterolet - att ta bort kolesterol från blodet genom att omvandla lipiden till en form som är lättare att förpacka och transportera. Det finns mer än 90 kända mutationer i LCAT, som kan orsaka antingen en partiell förlust av aktivitet (känd som "fiskögonsjukdom") eller fullständig förlust (FLD). Att öka LCAT-aktiviteten kan därför vara fördelaktigt vid behandling av personer med kranskärlssjukdom och LCAT-brist, men mekanismerna genom vilka den kan aktiveras är dåligt förstådda.
"I den här studien, vi använde strukturbiologi för att förstå hur en patenterad LCAT-aktivator binder till LCAT och hur den främjar kolesteroltransport, " säger huvudförfattaren Kelly Manthei, en postdoktor vid University of Michigan Life Sciences Institute, USA. "Vi frågade också om föreningen kunde hjälpa till att återställa aktiviteten hos LCAT-enzymer som ofta har observerat mutationer i FLD."
Teamet använde röntgenkristallografi för att titta på LCAT-enzymet stabiliserat i sitt aktiva tillstånd med två olika kemikalier - aktivatormolekylen, och en andra förening som efterliknar ett substrat bundet till enzymet. De två kemikalierna hade mer effekt på proteinet när de presenterades tillsammans än när de presenterades separat, vilket antydde att de binder till enzymet på olika ställen.
Ytterligare analys visade att aktivatormolekylen, till skillnad från andra kända LCAT-aktivatorer, binder till en region nära där HDL fäster. Dock, aktivatorn hjälpte inte LCAT att binda till HDL mer effektivt, vilket fick teamet att spekulera i att det istället hjälper till att överföra kolesterol och lipider till enzymets katalytiska centrum, så att den kan omvandla den till last för transport i HDL.
Efter att ha etablerat detta handlingssätt, forskarna testade om denna molekyl kunde hjälpa till att återställa kolesteroltransportfunktionen hos ett muterat LCAT-enzym. De gjorde en version av enzymet med en mutation som vanligtvis ses hos FLD-patienter, och testade sedan dess förmåga att binda till HDL och omvandla kolesterol i närvaro eller frånvaro av aktivatormolekylen. De var glada över att finna att aktivatorn delvis kunde vända förlusten av aktivitet i de muterade enzymerna, vilket resulterar i jämförbar kolesterolomvandling till det normala enzymet.
"Våra resultat kommer att hjälpa forskare att designa föreningar som bättre kan rikta in sig på LCAT så att de kan vara till terapeutisk nytta för hjärtsjukdomar och FLD-patienter, avslutar seniorförfattaren John Tesmer, Walther professor i cancerstrukturell biologi vid Purdue University, USA. "Framtida ansträngningar kommer att vara att undersöka om patienter med andra genetiska LCAT-mutationer kan dra nytta av föreningarna som används i denna studie, och att designa molekyler med förbättrade farmakologiska egenskaper för vidare utveckling."