Boston College kemister har utvecklat en ny, bakteriehärledd teknologi för att införliva icke-kanoniska aminosyror i proteiner från en bred klass av organismer, inklusive människor. Kredit:Cell Chemical Biology
Proteiner - de molekylära maskiner som driver de processer som ligger bakom biologin - är gjorda av bara 20 kanoniska byggstenar som kallas aminosyror. I nästan två decennier, forskare har sökt metoder för att konstruera nya aminosyror för att bygga proteiner.
Ett team av kemister från Boston College har utvecklat en teknik för att exakt införliva en rad användbara icke-kanoniska aminosyror i proteiner som tillverkas i eukaryoter, den breda klassen av högre organismer som inkluderar människor, laget rapporterade i journalen Cellkemisk biologi .
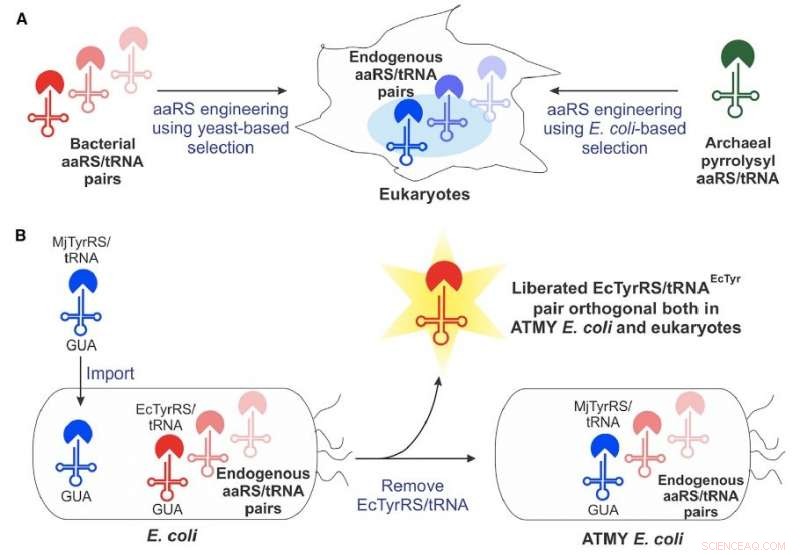
För ungefär 15 år sedan, forskare såg först potentialen hos en konstruerad, genetiskt maskineri som härrör från bakterier – känt som ett aminoacyl-tRNA-syntetas/tRNA-par – för att införliva icke-kanoniska aminosyror i proteiner som produceras i eukaryota celler. Men metoden har mött ett antal tekniska begränsningar som begränsat dess utbredda utveckling.
Boston College-teamet övervann många av dessa begränsningar genom att utveckla en ny stam av E. coli bakterier som möjliggör enkel konstruktion av det bakteriehärledda aminoacyl-tRNA-syntetas/tRNA-paret, enligt biträdande professor i kemi Abhishek Chatterjee, som ledde projektet. Detta nya tillvägagångssätt möjliggjorde inkorporering av olika icke-kanoniska aminosyror, inklusive p-borofenylalanin, till proteiner som produceras i mänskliga celler såväl som i den konstruerade stammen av E coli .
Chatterjee sa att laget var förvånat över möjligheten med det nya tillvägagångssättet, som beskrivs i den nya rapporten "Återuppliva det bakteriella tyrosyl-tRNA-syntetas/tRNA-paret för att utöka den genetiska koden för båda E coli och eukaryoter."
"Skapar den här romanen E coli stam krävde att sitt naturliga aminoacyl-tRNA-syntetas/tRNA-par ersattes med en motsvarighet från en annan organism, vilket vi trodde skulle bli mycket svårt, " sa han. "Men det visade sig vara ganska genomförbart. Det öppnar upp denna kompletta teknik."
Chatterjee sa att teamet försökte skapa en ny metod för att konstruera och övervaka proteinfunktioner som ett sätt att utöka den vetenskapliga förståelsen av processerna som styr proteinfunktioner i våra celler.
"Tusentals proteiner är kodade i genomet som gör oss till de vi är, men vi vet väldigt lite om den processen, " sa Chatterjee. "I mänskliga celler, det finns ungefär 20, 000 proteinkodande gener. Vad de gör och hur de gör det är fortfarande svårt att studera. Ett av de stora problemen är att om du vill veta vad de gör, du måste spionera på dem. Du måste bifoga en sond som kan rapportera tillbaka om vad som händer."
Att införa sådana sonder har visat sig vara svårt, eftersom processen ofta skadar målproteinet.
I vilken cell som helst, proteiner är gjorda av 20 aminosyror - en fast grupp som styrs i ordning av genetiska instruktioner.
"Tanken är att vi kan introducera en ny byggsten i proteiner som naturen inte har - utöver de 20 kanoniska aminosyrorna som naturen använder, " sa Chatterjee. "Om vi kan göra det, vi har förmågan att mycket specifikt introducera en mängd olika icke-naturliga funktioner på vilken plats som helst av praktiskt taget vilket protein som helst."
Den omedelbara fördelen skulle vara att hjälpa forskare som fortfarande håller på att reda ut mysterierna med cellbiologi och proteinfunktion.
"Du kan skapa ett protein med en icke-kanonisk aminosyra på vilken plats som helst, ladda den med sonder som är väldigt små och avger en optisk signal som talar om vart den är på väg, ", sade Chatterjee. "Den kan tillåta dig att manipulera hur proteinet fungerar. Du kan införa gränser, så vad proteinet än gör, det kan inte göra mer. Och du kan ta bort sonden genom att använda en extern signal som ljus. Denna teknik öppnar upp för många nya sätt att börja undersöka och konstruera proteinfunktion, vilket skulle vara väldigt utmanande annars."