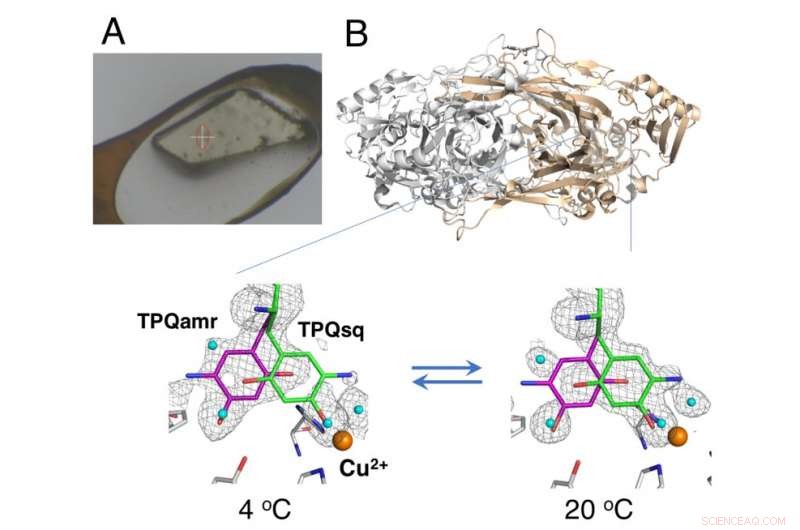
Ickkryokyld kristall monterad med HAG-metoden (A) och temperaturberoende jämviktsförändring av katalytiska mellanprodukter i kopparaminoxidas (B). Upphovsman:Osaka University
Enzymer - biokatalysatorer gjorda av proteiner - är oerhört viktiga molekyler som katalyserar reaktionerna och processerna i levande organismer. Pågående arbete för att förstå deras strukturer och reaktionsmekanismer är därför avgörande för att bredda vår kunskap och bidra till vetenskapliga och medicinska framsteg.
Röntgenkristallografi-i vilken proteinkristaller exponeras för en röntgenstråle, vilket resulterar i specifika diffraktionsmönster som kan analyseras-är den mest använda tekniken för proteinstrukturbestämning. Datainsamling i röntgenkristallografi innebär vanligtvis att kristaller placeras under en kryogen gasström vid 100 K; dock, de kryogena förhållandena tillåter i allmänhet inte termodynamisk analys av konformationsförändringarna i proteinkristallerna. Nu, forskare från Osaka University, Osaka Medical College, Japan Synchrotron Radiation Research Institute (JASRI), och RIKEN har rapporterat detaljerna om strukturförändringar under den katalytiska reaktionen av ett kopparaminoxidas med användning av en icke-kryogen teknik. Deras resultat publicerades i PNAS .
Studien använde en metod "fuktig luft och limbeläggning (HAG)" som utvecklats av JASRI vid synkrotronanläggningen SPring-8. Istället för kryogen kylning, de ofriade proteinkristallerna belades med en vattenlöslig polymer och placerades under en ström av fuktig kvävgas med exakt reglerad temperatur. Detta gjorde det möjligt för den nästan kala kristallen att förbli stabil nog för att laget skulle kunna bedöma jämvikten mellan de strukturellt distinkta konformationerna för redox -kofaktorn (en väsentlig komponent i den katalytiska reaktionen) vid en viss temperatur.
"Som ett resultat av den exakta temperaturkontroll vi kunde uppnå, vi demonstrerade den första framgångsrika i kristallo termodynamisk analys av arbetsenzymet, "säger studiens motsvarande författare Toshihide Okajima." Termodynamiska analyser baserade på kristallmätningar ger en närmare representation av strukturförändringarna än data som erhållits från lösningsstudier, och är därför mer värdefulla för vår förståelse. "
Dessutom, de erhållna termodynamiska parametrarna visade ett beteende som liknade det i cytosol i cellerna. Man tror därför att HAG -förhållandena kan ge en användbar modell för fysiologiska tillstånd. Olika andra kristallografiska tekniker har rapporterats för användning vid omgivningstemperatur; dock, de kräver specialiserade röntgenfria lasrar.
"Genom att använda den temperaturstyrda HAG-metoden, vi har visat att det är möjligt att skaffa konformationsinformation med en vanlig röntgenstråle, "Okajima förklarar." Vi hoppas att teknikens tillgänglighet och dess möjligheter att tillhandahålla termodynamisk information kommer att göra den till ett viktigt komplement till nuvarande kristallografiska tillvägagångssätt. "