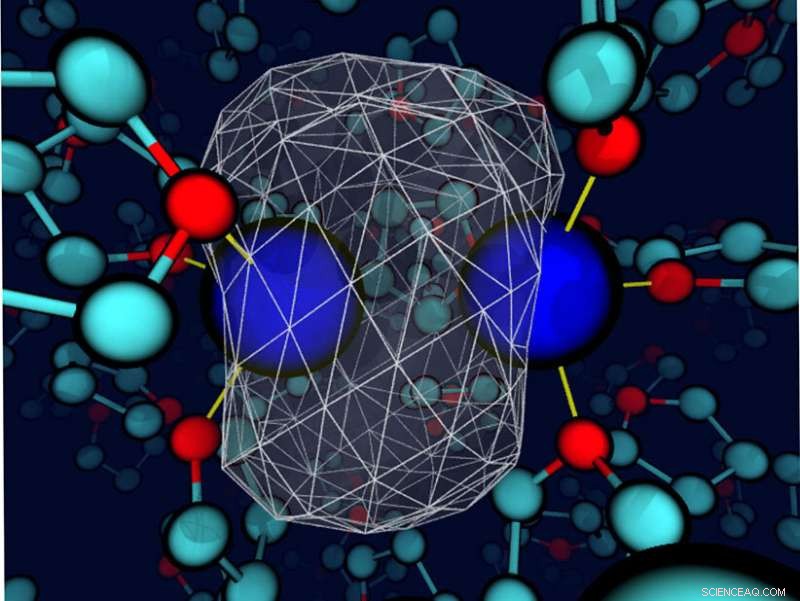
En "ögonblicksbild" avslöjar att det omgivande tetrahydrofuranlösningsmedlet deformerar bindningselektrondensiteten runt ett löst natrium. Natriumkärnorna är blåa sfärer; valenselektronernas densitet representeras som en transparent vit yta med ett vitt trådnät som omsluter det mesta av laddningstätheten. Bindningarna mellan natrium och närliggande lösningsmedels syreställen är tunna gula linjer. Kredit:Devon Widmer, University of California, Los Angeles
Kasta några hela mandlar i en burk full med hasselnötter. Skaka. Nötterna studsar mot varandra, men de reagerar inte. Det är så som vissa människor tänker på reaktioner som sker inuti vätskor. De lösta ämnena (mandlarna) reagerar med varandra i ett hav av lösningsmedel (hasselnötter). Men en ny studie visar att det inte alltid är fallet för riktiga kemiska reaktioner. Under rätt förutsättningar, lösningsmedlet kan ändra det lösta ämnets kemiska identitet.
Många kemiska reaktioner, särskilt de som är relevanta för att hålla människor och växter vid liv, ske i lösning. Denna forskning visar att i många sådana reaktioner, lösningsmedlet är inte bara en åskådare. Det innebär att omarbeta förväntningar och beräkningsmodeller. Eftersom samma regler kan gälla i kemilabb, forskare kan behöva välja sina lösningsmedel med mer omsorg. Lösningsmedlen kan kontrollera eller ändra den kemiska identiteten hos det lösta ämnet.
Även om lösningsmedel är noggrant utvalda i vissa fall, vätskorna anses ofta helt enkelt vara ett medium för att reaktanterna ska kunna möta varandra. Dock, lösningsmedlet kan spela en större roll. Här, forskare fann att när lösningsmedlet och det lösta ämnet interagerar (energetiskt i samma ordning som en vätebindning), lösningsmedlet kan styra bindningsdynamiken och den kemiska identiteten hos enkla lösta ämnen. Forskarna kom till denna slutsats genom att studera en natriumdimer i det svagt polära lösningsmedlet tetrahydrofuran. Bindningsinteraktioner mellan lösningsmedlet och natriumatomerna ledde till unika koordinationstillstånd. Dessa stater var tvungna att passera en fri energibarriär, i huvudsak genomgår en kemisk reaktion, att interkonvertera. Ytterligare, varje koordinationstillstånd hade sin egen dynamik och spektroskopiska signaturer. Även om kemister länge har varit medvetna om inverkan av lösningsmedel i vissa fall, denna forskning belyser värdet av att noggrant välja lösningsmedlet för att skapa en specifik miljö i vissa kemiska system med kondenserad fas.