Trender i det periodiska systemet. Kredit:Sandbh/Wikipedia, CC BY-SA
Nyheten kom att en järnvägsvagn, laddad med rent natrium, hade precis spårat ur och höll på att spilla ut innehållet. En tv-reporter ringde mig för att få en förklaring om varför brandmän inte fick använda vatten på lågorna som slog upp från den trasiga bilen. Medan jag var i luften tillsatte jag lite natrium till lite vatten i en petriskål och vi observerade den onda reaktionen. För ytterligare dramatisk effekt, Jag lade också lite kalium i vatten och förvånade alla med de explosiva blåaktiga lågorna.
Eftersom grupp I-metaller, även känd som alkalimetaller, är mycket reaktiva, som natrium från järnvägsvagnen eller kalium, de finns inte i naturen i ren form utan bara som salter. De är inte bara mycket reaktiva, de är mjuka och glänsande, kan lätt skäras även med en matt kniv och är de mest metalliska av alla kända element.
Jag är en kemist som tillbringade sin karriär med att bygga nya molekyler, ibland med grupp I-element. Genom att studera beteendet och trenderna för grupp I-element, vi kan få en glimt av hur det periodiska systemet är uppbyggt och hur man tolkar det.
Det grundläggande
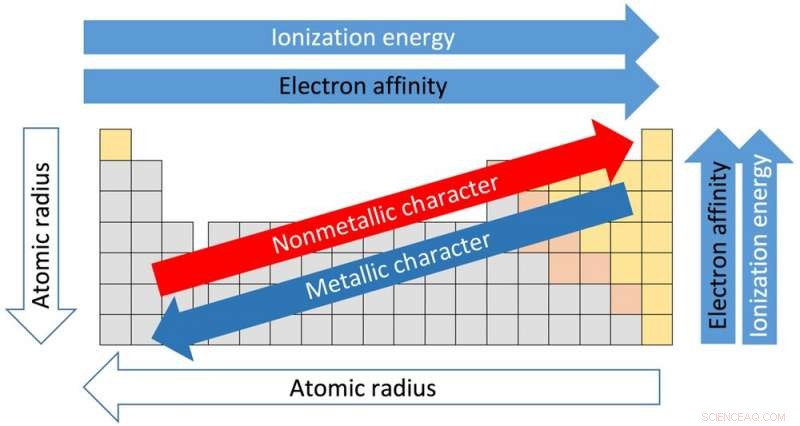
Arrangemanget av det periodiska systemet och egenskaperna för varje element i det baseras på atomnumret och arrangemanget av elektronerna som kretsar kring kärnan. Atomnumret beskriver antalet protoner i elementets kärna. Vätets atomnummer är 1, helium är 2, litium är 3 och så vidare.
Var och en av de 18 kolumnerna i tabellen kallas en grupp eller en familj. Element i samma grupp delar liknande egenskaper. Och fastigheterna kan antas utifrån läget inom koncernen. Gå från toppen av grupp I till botten, till exempel, atomradierna – avståndet från kärnan till de yttre elektronerna – ökar. Men mängden energi som behövs för att slita av en yttre elektron minskar från toppen till botten eftersom elektronerna är längre bort från kärnan och inte hålls lika hårt.
Detta är viktigt eftersom hur element interagerar och reagerar med varandra beror på deras förmåga att förlora och få elektroner för att göra nya föreningar.
De horisontella raderna i tabellen kallas perioder. Flytta från vänster sida av perioden till höger, atomradien blir mindre eftersom varje grundämne har en extra proton och en extra elektron. Fler protoner innebär att elektroner dras in tätare mot kärnan. Av samma anledning ökar elektronegativiteten – graden till vilken ett element tenderar att få elektroner – från vänster till höger.
Kraften som krävs för att ta bort den yttersta elektronen, känd som joniseringspotentialen, ökar också från vänster sida av bordet, som har element med metallisk karaktär, till höger sida, som är icke-metaller.
Elektronegativiteten minskar från toppen av kolumnen till botten. Smältpunkten för elementen inom en grupp minskar också från toppen till botten av en grupp.
Tillämpa grunderna på element i grupp I
Som namnet antyder, Grupp I-element upptar den första kolumnen i det periodiska systemet. Varje element startar en ny period. Litium är i toppen av gruppen och följs av natrium, Na; kalium, K; rubidium, Rb; cesium, Cs och slutar med det radioaktiva franciumet, Fr. Eftersom det är mycket radioaktivt, praktiskt taget ingen kemi utförs med detta element.
Eftersom varje element i denna kolumn har en enda yttre elektron i ett nytt skal, volymerna av dessa element är stora och ökar dramatiskt när man flyttar från toppen till botten av gruppen.
Av alla element i grupp I, cesium har de största volymerna eftersom den yttersta enskilda elektronen hålls löst.
Trots dessa trender, egenskaperna hos elementen i grupp I liknar varandra mer än för någon annan grupp.
Alkalimetaller genom historien
Att använda kemiska egenskaper som sin vägledning, Den ryske kemisten Dimitri Mendeleev ordnade korrekt de första grundämnena i grupp I i sitt periodiska system från 1869. Det kallas periodiskt eftersom vart åttonde element upprepar egenskaperna för det ovanför i tabellen. Efter att ha arrangerat alla då kända element, Mendeleev tog det djärva steget att lämna tomrum där hans extrapolering av kemiska egenskaper visade att ett grundämne borde existera. Efterföljande upptäckt av dessa nya element visade att hans förutsägelse var korrekt.
Vissa alkalimetaller har varit kända och kommit till god användning långt innan Mendeleev skapade det periodiska systemet. Till exempel, Gamla testamentet nämner salt - en kombination av alkalimetallnatrium med klor - 31 gånger. Nya testamentet hänvisar till det 10 gånger och kallar natriumkarbonat för "neter" och kaliumnitrat för "saltpeter".
Folk har vetat sedan antiken att träaska producerar ett kaliumsalt som, i kombination med animaliskt fett, kommer att ge tvål. Samuel Hopkins erhöll det första amerikanska patentet den 31 juli, 1790, för tvål enligt den nya patentstadgan som just undertecknats av president George Washington några månader tidigare.
Den pyrotekniska industrin älskar dessa grupp I-element för deras livfulla färger och explosiva natur. Brinnande litium ger en livlig karmosinröd färg; natrium en gul; kalium lila; rubidiumröd; och cesiumviolett. Dessa färger produceras när elektroner hoppar från sin hemmiljö och kretsar kring kärnan och återvänder tillbaka igen.
cesium atomklockan, den mest exakta klocka som någonsin utvecklats, fungerar genom att mäta frekvensen av cesiumelektroner som hoppar fram och tillbaka mellan energitillstånd. Klockor baserade på elektronhoppning ger ett extremt exakt sätt att räkna sekunder.
Andra applikationer inkluderar natriumånglampor och litiumbatterier.
I min egen forskning har jag använt grupp I-metaller som verktyg för att utföra annan kemi. En gång var jag i behov av absolut torr alkohol, och det torraste jag kunde köpa innehöll fortfarande små spår av vatten. Det enda sättet att bli av med den sista resten av vatten var att behandla den vattenhaltiga alkoholen med natrium – ett ganska dramatiskt sätt att ta bort vatten.
De alkaliska elementen upptar inte bara den första kolumnen i det periodiska systemet, men de visar också mest reaktivitet av alla grupper i hela tabellen och har de mest dramatiska trenderna i volym och joniseringspotential, samtidigt som de upprätthåller stor likhet med varandra.
Den här artikeln är återpublicerad från The Conversation under en Creative Commons-licens. Läs originalartikeln. 