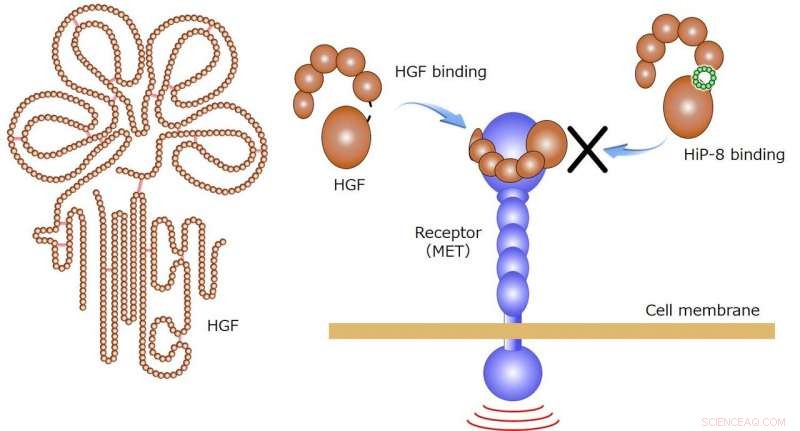
HGF utövar sina fysiologiska funktioner genom att binda till sin receptor MET på cellmembranet. Vid bindning av HiP-8 till HGF, HGF-bindning till receptorn MET hämmas (höger sida av figuren). Kredit:Kanazawa University
Hepatocyt Growth Factor (HGF) är ett protein som fungerar som en celltillväxtfaktor. Genom att binda till dess receptorprotein MET på cellmembranet, det utövar sina fysiologiska funktioner såsom proliferation och migration av celler, samt vävnadsreparation och regenerering. Men för en cancervävnad, eftersom det främjar invasion och överlevnad av cancerceller, det kan spela roller i cancermetastaser och förvärv av resistens mot läkemedel mot cancer. HGF finns i en prekursorform, inaktiv HGF, i olika vävnader, men prekursorn omvandlas till aktiv HGF endast i närheten av cancerceller. På grund av detta skäl, molekyler som selektivt detekterar/hämmar aktivt HGF är mycket önskvärda men har inte beskrivits hittills.
Molekylärt riktade läkemedel som selektivt hämmar specifika molekyler har utvecklats och används för cancerbehandling och för andra sjukdomar. Bland andra, antikroppar visar hög specificitet mot sina målmolekyler, men en av deras nackdelar är deras mycket höga kostnad. Å andra sidan, syntetiska läkemedel är mycket billigare eftersom de kan syntetiseras kemiskt men deras specificitet mot sina målmolekyler är inte hög. Nyligen, stor uppmärksamhet har ägnats åt makrocykliska peptider, som kan uppvisa målspecificitet lika hög som antikroppar och ändå kan vara tillgänglig genom kemisk syntes.
Det nuvarande forskarteamet från fem institutioner inklusive Kanazawa University har framgångsrikt upptäckt en makrocyklisk peptid, HiP-8, som binder till den aktiva formen av HGF för att hämma dess aktivitet, med hjälp av PaPID-metoden. HiP-8 är en makrocyklisk peptid som består av 12 aminosyrarester i en ringliknande geometri (Figur 1), bindning till aktiv HGF med mycket hög affinitet och hämmar HGF-bindning till dess receptor, MET (Figur 1).
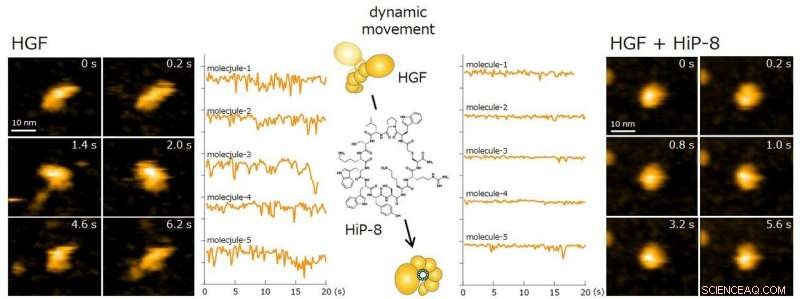
Gula linjer visar förändring i molekylform av HGF-molekyler. Medan HGF-morfologi genomgår dynamisk rörelse, den dynamiska rörelsen (molekylär dynamik) undertrycktes kraftigt vid bindning av HiP-8. Kredit:Kanazawa University
Dessutom, för att belysa den funktionella interaktionen mellan HiP-8 och HGF, denna studie använde höghastighets atomkraftsmikroskopi (HS-AFM) utvecklad vid Kanazawa University, vilket möjliggör visualisering av dynamiken och morfologin hos biologiska molekyler (Figur 2). Denna undersökning visade framgångsrikt att, medan en aktiv HGF-molekyl uppvisade dynamiskt beteende, vid bindning av HiP-8, den molekylära dynamiken hos HGF hämmades starkt. Denna nya upptäckt visar att den mycket dynamiska naturen hos en proteinmolekyl hämmades av en liten molekyl.
Ytterligare, bildanalys med hjälp av positronemissionstomografi (PET) och radiomärkt HiP-8 administrerat till möss xenotransplanterade med mänsklig lungcancervävnad, föreslå en möjlig tillämpning av HiP-8 för cancerdiagnos. HiP-8 ackumuleras selektivt i cancervävnad med aktiv HGF (Figur 3), vilket tyder på att HiP-8 bör vara användbar som en sond för PET-bilddiagnostik. Eftersom HiP-8 hämmar HGF-aktivitet, det skulle också kunna användas som ett molekylärt riktat läkemedel mot cancer som är selektivt för aktiv HGF.
Resultaten av denna studie förväntas leda till utvecklingen av nya PET-diagnostiksmetoder med radiospårning HiP-8, en makrocyklisk peptid. HiP-8 är en kandidatmolekyl till ett nytt molekylärt riktat läkemedel som selektivt hämmar endast aktiv HGF.
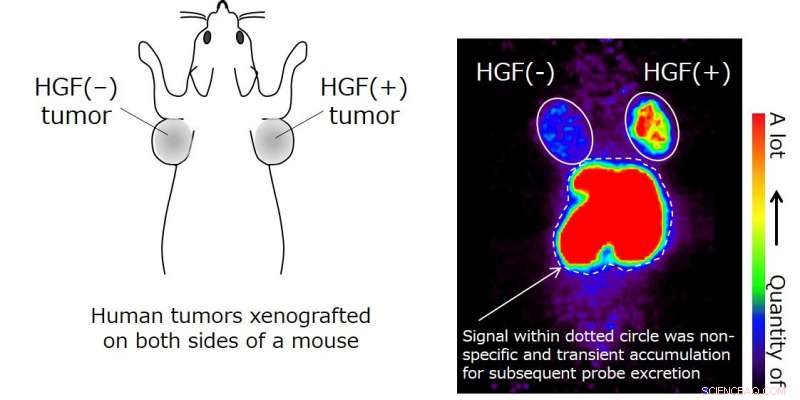
HiP-8 (sond) observeras ackumuleras i en HGF(+)-tumör (xenotransplanterad på en mus). HiP-8-signalen i lever och njure indikerar övergående ackumulering av HiP-8 för efterföljande utsöndring. Cancervävnaden där HGF-nivån var högre visualiserades med hög kontrast, jämfört med HGF(?)-tumör. Kredit:Kanazawa University