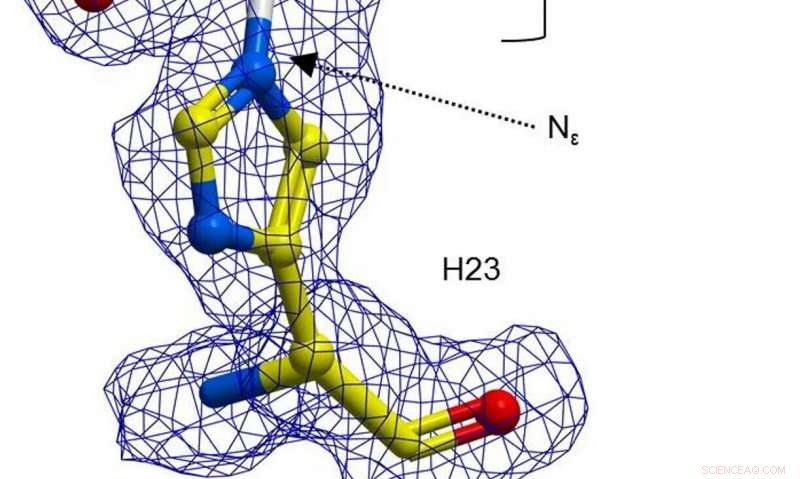
En boll-och-stick-representation av H23 från BH32 hämmad med 2-bromacetofenon, färgad efter atomtyp med H23-kolatomer i gult och acetofenonkol i vitt. Klar FEM-elektrondensitet (blå, konturerad vid 1σ) sträcker sig mellan Nε för H23 och acetofenon. Kreditera: Natur (2019). DOI:10.1038/s41586-019-1262-8
Ett team av kemister vid University of Manchester har hittat ett sätt att införliva en onormal rest i ett enzym för att visa hur det katalytiska intervallet av enzymer kan utökas. I deras papper publicerad i tidskriften Natur , gruppen beskriver att utöka utbudet av katalytiska enzymer som skulle kunna användas för att tillhandahålla ett bredare utbud av sidokedjor för katalys – genom att använda ett utökat "alfabet" av aminosyror. Adam Nelson, med University of Leeds, har publicerat en News and Views Research-artikel som diskuterar lagets arbete i samma tidskriftsnummer.
Som Nelson noterar, det finns inte särskilt många naturliga aminosyrarester som kan användas av enzymer för att katalysera reaktioner – han noterar att det bara finns 20 sorter som kan användas för att bygga sådana enzymer. Denna brist på alternativ har fått forskare att överväga om utbudet av aminosyror som skulle kunna användas av enzymer för att möjliggöra fler katalytiska reaktioner skulle kunna breddas - kanske genom att använda vad forskarna beskriver som ett "alfabet" av aminosyror som levererar en bredare olika sidokedjor som kan användas för katalys. I denna nya ansträngning, forskarna använde ett så utökat alfabet av aminosyror för att utöka utbudet av möjligheter. De rapporterar att på så sätt, de kunde konstruera ett enzym med hjälp av medlemmar av en onaturlig katalytisk grupp och visade att det kunde leda till förbättringar med hjälp av en metod som kallas riktad evolution.
I sitt arbete, forskarna valde att omforma ett enzym för att göra det till en mer effektiv katalysator – de började med att notera att en histidinaminosyrarest i enzymet BH32 kan bilda en mellanliggande acylenzymförening. Den mellanprodukten hydrolyserades för att skapa en produkt från reaktionen, men resultatet blev inte som förväntat. Teamet använde sedan riktad evolution för att optimera rollen för Nδ-metylhistidin. Det involverade ett antal metoder för att tvinga mutationer. Som ett resultat, teamet upptäckte en variant som heter OE1.3, vilket testet visade var mer effektivt. Teamet fortsatte med en mer riktad utveckling och kom så småningom fram till OE1.4 - ett enzym som visade förbättrad katalytisk aktivitet.
© 2019 Science X Network