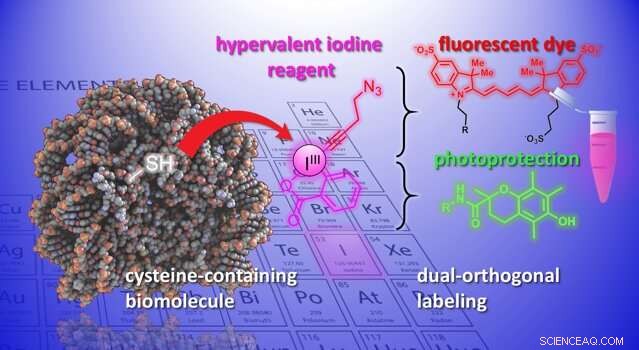
En illustration av den kemiska reaktionen som utvecklats i studien. Kredit:J. Waser/B. Fierz (EPFL)
Att förstå strukturen och metabolismen hos celler och levande organismer är avgörande för utvecklingen av nya läkemedel och diagnostik. Tillgängligheten av kemiska verktyg som gör det möjligt för forskare att redigera biomolekyler, som proteiner, med upplösning på atomnivå har i hög grad bidragit till den kemiska biologins framsteg.
Proteiner är makromolekyler konstruerade av en uppsättning av tjugo kemiskt olika aminosyror. En nyckelmetod för att modifiera proteiner är att reagera med svavelatomen i aminosyran cystein. Dock, nuvarande metoder är fortfarande problematiska när det gäller effektivitet, selektivitet, och stabiliteten hos slutprodukten ("addukten").
Nu, Jérôme Wasers och Beat Fierz labb vid EPFLs Institute of Chemical Sciences and Engineering har utvecklat en ny metod för att modifiera cysteiner på peptider och proteiner. Metoden använder en grupp mycket reaktiva organiska molekyler, etynylbensiodoxolonerna (EBX). Det som gör EBX mycket reaktiva är att de innehåller en jodatom bunden till tre substituentgrupper. Denna icke-naturliga situation leder till hög reaktivitet i dessa så kallade "hypervalent jod"-reagens.
För första gången, forskarna kunde generera en enkel biomolekyl-EBX-addukt samtidigt som de behöll sin reaktiva jodgrupp i den slutliga molekylen. Reaktionen kan enkelt utföras av en icke-expert under fysiologiska standardbetingelser.
Slutprodukten är proteinhypervalenta jodreagenskimärer som kan fungera som dubbla fästpunkter för två nya kemiska grupper, öppna upp för nya möjligheter för studier av biologiska processer.
"En ny funktionalitet kan introduceras via" klick-kemi, ' en väletablerad reaktion inom kemisk biologi, " säger Waser. "Med en palladiumkatalysator, en annan selektiv modifiering kan uppnås vid den reaktiva jodatomen - vad vi skulle kalla en "biortogonal" funktionalitet, eftersom det inte finns i naturen." Att införa sådana exotiska reaktiva grupper i biomolekyler är för närvarande ett av de viktigaste verktygen inom kemisk biologi, eftersom det gör det möjligt att studera biologiska processer utan att störa dem.
Forskarna visade metodens potential genom att introducera en mångfald av kemiska grupper i biomolekyler. Till exempel, forskarna använde det dubbla handtaget för att fästa ett fluorescerande färgämne och en fotoskyddande grupp i en neuropeptid samtidigt. Att kombinera dem förbättrar färgämnets fotostabilitet, och möjliggör hög upplösning, enkelmolekylavbildning av molekylära interaktioner.
Utöver peptider, de modifierade ytterligare små proteiner, och även stora protein-DNA-komplex, så kallade nukleosomer. När nukleosomer organiserar genomet, märkning av dem med fluorescerande färgämnen kan hjälpa till att spåra dem för att dechiffrera hur naturen reglerar genuttryck.
"Det vi utvecklat här är en ny metod för att modifiera proteiner baserat på grundläggande studier av kemisk reaktivitet, " säger Fierz. "Vi har redan använt det för att modifiera histoner, och genomförde fluorescensförsök på levande celler. Med dessa exempel, vi har lagt grunden för en bättre förståelse av biologiska processer."
Studien publiceras i Chem i dag.