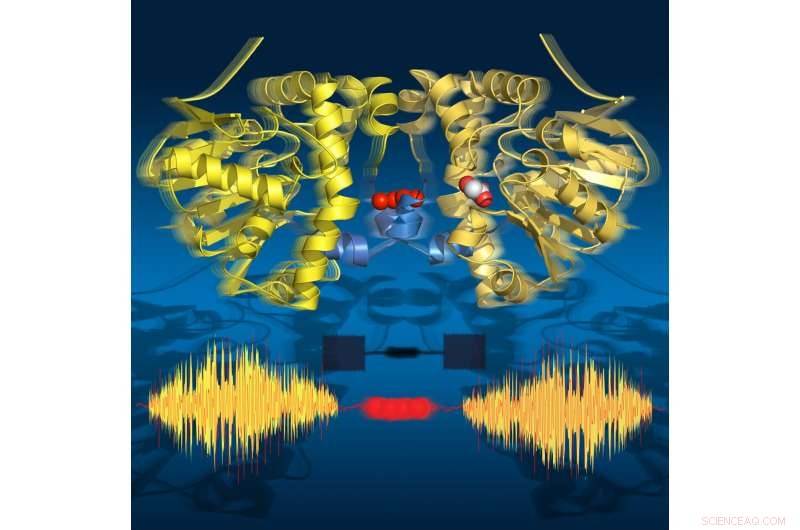
Time-lapse-bilder visar att enzymet "andas" under omsättning:det expanderar och drar ihop sig i linje med de katalytiska delstegen. Dess två halvor kommunicerar via en sträng av vattenmolekyler. Kredit:Joerg M. Harms, MPSD
Forskare från institutionen för atomiskt upplöst dynamik vid Max Planck-institutet för materiens struktur och dynamik (MPSD) vid Center for Free-Electron Laser Science i Hamburg, University of Potsdam (både i Tyskland) och University of Toronto (Kanada) har sammanställt en detaljerad time-lapse-film som avslöjar alla viktiga steg under ett enzyms katalytiska cykel. Förvånande, kommunikationen mellan proteinenheterna åstadkommes via ett vattennätverk som liknar en strängtelefon. Denna kommunikation är i linje med en "andningsrörelse", det är proteinets expansion och sammandragning. Denna tidsförloppssekvens av strukturer avslöjar dynamiska rörelser som ett grundläggande element i biologins molekylära grundvalar.
Allt liv är dynamiskt och likaså dess molekylära byggstenar. Biomolekylernas rörelser och strukturella förändringar är grundläggande för deras funktioner. Dock, att förstå dessa dynamiska rörelser på molekylär nivå är en formidabel utmaning. Hur kan ett protein påskynda en kemisk reaktion, som skulle ta år att fortsätta utan hjälp?
För detta ändamål vände sig forskarna till ett enzym som splittrar den starkaste enkelbindningen i organisk kemi:C-F-bindningen. Fluorerade kol finns i material som teflon eller GoreTex och i många läkemedel och bekämpningsmedel. Fluorerade föreningar har en särskild inverkan på klimatförändringar, överskrider effektiviteten av CO 2 i storleksordning. Därför, förmågan att bättre förstå och så småningom kontrollera omsättningen av C-F-obligationer är av särskilt intresse för klimatförändringar och biosanering.
Forskarna använde tidsupplöst röntgenkristallografi för att ta molekylära ögonblicksbilder under omsättningsreaktionen av detta naturliga enzym vid fysiologiska temperaturer. Denna time-lapse-film avslöjade arton tidpunkter från 30 millisekunder till 30 sekunder, täcker alla viktiga katalytiska tillstånd som leder till att C-F-bindningen bryts. Förvånande, filmen visar också att enzymet "andas" under omsättning, det vill säga att den expanderar och drar ihop sig i linje med de katalytiska delstegen.
Slående, de två halvorna av enzymet kommunicerar med varandra via en sträng av vattenmolekyler som förbinder båda halvorna. Detta vattennätverk tillåter de två halvorna att "prata" med varandra och dela information om deras katalytiska tillstånd. Detta är avgörande för enzymets funktion då endast hälften av enzymet någonsin kan vara aktivt vid en given tidpunkt.
Dessa dynamiska förändringar har visat sig vara avgörande för enzymets funktion. Forskarna förväntar sig att många andra system ska utnyttja liknande mekanismer för sin verksamhet.