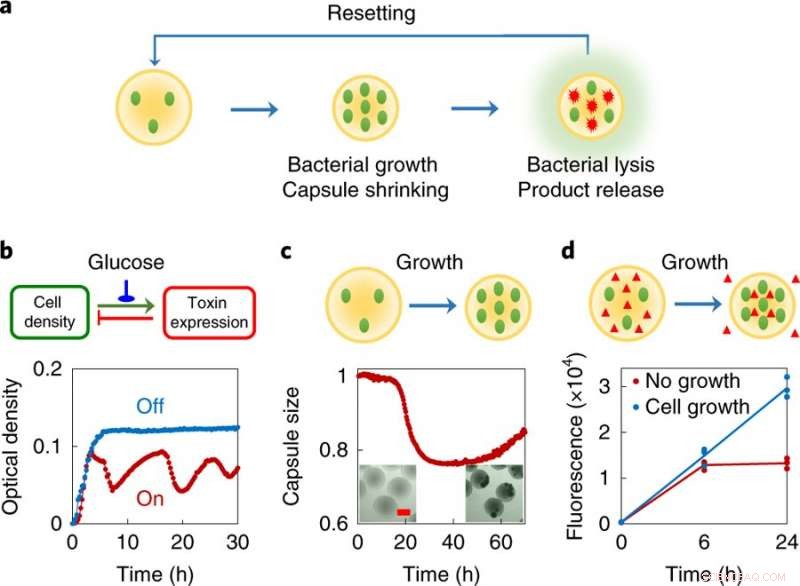
a, Design koncept, varje svärmbot består av en liten population av konstruerade bakterier inkapslade i polymera mikrokapslar. Dessa bakterier är konstruerade för att genomgå partiell lysis vid en tillräckligt hög lokal densitet. Omvänt, det inkapslande materialet kommer att krympa som svar på den förändrade kemiska miljön som orsakas av celltillväxt. När bakterierna genomgår programmerad autolys, de frisätter intracellulära proteiner. De tvärbundna polymerkapslarna fångar de levande cellerna och stora skräp inuti, och motsvarande krympning underlättar exporten av proteinprodukter från kapslarna. Systemet återställs genom att fylla på med färskt medium. b, Programmerad autonom lysering av ePop-kretsen (överst, kretslogik; botten, experimentella data). En densitetsberoende ökning av antalet plasmidkopior leder till en ökning av uttrycket av ett toxin (E-proteinet från fag φX174). Vid en tillräckligt hög koncentration, E-proteinet orsakar cellys, leder till en minskning av celldensiteten. När den är påslagen (röd kurva), kretsen ledde till en reducerad odlingsdensitet av MC4100Z1(ePop) balanserad av tillväxt och reglerad avdödning. För syftet med den övergripande systemdesignen, genereringen av svängningar är inte väsentlig. Kretsen kan stängas av (blå kurva) genom att tillsätta 1 % glukos. Experimentet upprepades mer än tre gånger oberoende med liknande resultat. c, Krympning av kapslar som svar på tillväxt av inkapslade bakterier (överst, schematisk; botten, experimentella data). MC4100Z1(ePop/GFP)-celler inkapslades i kitosankapslar och odlades i M9. Alla data normaliserades till värdet vid tidpunkten noll. Infälld, mikroskopibilder av MSB efter 0 h (vänster) och 48 h (höger). Skalstång, 200 μm. Experimentet upprepades mer än tre gånger oberoende med liknande resultat. d, Tillväxtmedierad kapselkrympning underlättar export av makromolekyler från kapslarna (överst, schematisk; botten, experimentella data). MG1655-celler och dextran-rhodamin (molekylvikt ≈ 70, 000 g mol−1) inkapslades i kitosankapslarna och odlades i M9. Kapslar behandlades med eller utan ampicillin (100 μg ml−1). Krympande kapslar, orsakas av bakterietillväxt i frånvaro av antibiotika, ledde till en ~2,25-faldig ökning av rhodaminfluorescensen jämfört med icke-krympande kapslar efter 24 h, som innehöll icke-växande bakterier (undertryckta av antibiotika). Experimentet gjordes i tre exemplar som oberoende biologiska replikat och data visas som individuella prickar, linjen anger medelvärdet. Kreditera: Naturens kemiska biologi (2019). DOI:10.1038/s41589-019-0357-8
Biomedicinska ingenjörer vid Duke University har utvecklat en ny plattform för att skapa biologiska läkemedel med hjälp av speciellt framställda bakterier som spricker och frigör användbara proteiner när de känner att deras kapsel blir för trång.
Plattformen bygger på två huvudkomponenter:de konstruerade bakterierna, kallas "svärmbots, " som är programmerade att känna av tätheten hos sina kamrater i sin behållare, och biomaterialet som begränsar svärmbottarna, en porös kapsel som kan krympa som svar på förändringar i bakteriepopulationen. När det krymper, kapseln pressar ut målproteiner som skapats av de fångna bakterierna.
Denna fristående plattform kan göra det lättare för forskare att skapa, analysera och rena olika biologiska läkemedel för användning i småskalig biotillverkning.
Forskningen dök upp online den 16 september i tidskriften Naturens kemiska biologi .
Bakterier används vanligtvis för att producera biologiska läkemedel, som är produkter som vacciner, genterapier och proteiner som skapas eller syntetiseras från biologiska källor. För närvarande, denna process involverar en serie sofistikerade steg inklusive cellodling, proteinisolering och proteinrening, var och en kräver känslig infrastruktur för att säkerställa effektivitet och kvalitet. För industriell verksamhet, dessa steg utförs i stor skala. Även om detta hjälper till att producera stora mängder av vissa molekyler, den här installationen är inte flexibel eller ekonomiskt lönsam när forskare behöver producera små mängder olika biologiska läkemedel eller arbeta i resursbegränsade miljöer.
Den nya tekniken utvecklades av Lingchong You, professor i biomedicinsk teknik vid Duke University, och en före detta hertig postdoktoral forskare, Zhuojun Dai, nu docent vid Shenzhen Institute of Advanced Technologies. I den nya studien, de visar hur deras nya plattform använder kommunikation mellan swarmbots och deras kapsel för att uppnå mångsidig produktion, analys och rening av olika proteiner och proteinkomplex.
I ett tidigare proof of concept, Du och hans team konstruerade en icke-patogen stam av E. coli-bakterier för att producera ett motgift mot antibiotika när bakterierna nådde en viss densitet. Dessa svärmbottar var sedan begränsade till en kapsel, som badades i antibiotika. Om en bakterie lämnade kapseln förstördes den, men om det förblev inne i behållaren där befolkningstätheten var hög, den överlevde.
"Vår första studie visade i huvudsak envägskommunikation, där cellerna kunde känna av miljön i kapseln men miljön inte reagerade på cellerna, sa du. "Nu, vi har tvåvägskommunikation - de konstruerade svärmbottarna kan fortfarande känna sin täthet och sin instängdhet, men vi har introducerat ett material som kan svara när bakteriepopulationen inuti det förändras. Det är som att de två komponenterna pratar med varandra, och tillsammans ger de dig ett mycket dynamiskt beteende."
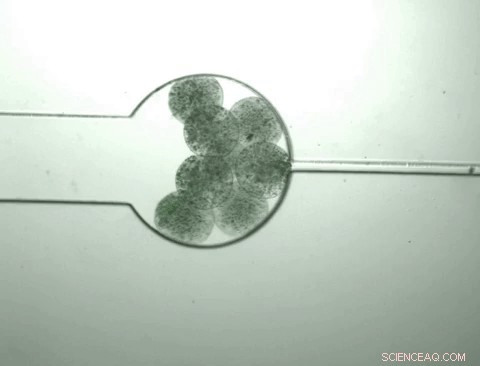
Kapslar som innehåller skräddarsydda bakterier som kallas "swarmbots" växer och krymper som svar på den kemiska miljön de innehåller. Svärmbottarna känner att deras egen befolkningstäthet har nått en viss nivå och delas upp för att släppa deras innehåll, inklusive ett protein som de har konstruerats för att tillverka. Kapseln krymper sedan och processen återupptas när näringsämnen införs. Kredit:Zhuojun Dai
När populationen inuti kapseln når en viss täthet, bakterierna börjar poppa, ' släpper allt deras cellulära innehåll, inklusive proteinprodukten av intresse. På samma gång, denna bakterietillväxt förändrar den kemiska miljön i kapseln, får den att krympa. När den krymper, det pressar ut proteinet som frigörs från de sprängda cellerna medan bakterierna och cellrester hålls i kapseln.
När proteinerna har samlats in, forskare kan lägga till ett näringstillskott till skålen som en signal för att kapslarna ska förstoras. Detta återställer den inre miljön och låter bakterierna börja växa igen, starta om processen. Enligt dig, denna cykel kan upprepas i upp till en vecka.
För att göra tillvägagångssättet användbart för biotillverkning, teamet lade till kapslarna till ett mikrofluidchip, som inkluderade en kammare för dem att detektera och kvantifiera vilka proteiner som frigjordes. Detta kan ersättas med en reningskammare för att förbereda proteinerna för användning i biologiska läkemedel.
"Det är en väldigt kompakt process. Du behöver ingen el, och du behöver ingen centrifug för att producera och isolera dessa proteiner, " sa du. "Det gör detta till en bra plattform för biotillverkning. Du har förmågan att producera en viss typ av medicin i ett mycket kompakt format till en låg kostnad, och det är lätt att leverera. Dessutom, Denna plattform erbjuder ett enkelt sätt att producera flera proteiner samtidigt."
Enligt dig, denna användarvänlighet har gjort det möjligt för teamet att producera, kvantifiera och rena mer än 50 olika proteiner i samarbete med labbet av Ashutoshi Chilkoti, Alan L. Kaganov Professor och ordförande för institutionen för biomedicinsk teknik vid Duke. De har också utforskat hur deras plattform kan förenkla skapandet av proteinkomplex, som är strukturer gjorda av flera proteiner.
På ett proof-of-concept experiment för att producera en fettsyrasyntesväg från flera enzymer, "vi kunde använda sju versioner av våra mikrobiella svärmbotar, som var och en var programmerad att producera ett annat enzym, sa du. Vanligtvis, för att skapa en metabolisk väg måste du balansera leveranskedjan, vilket skulle kunna innebära att uppreglera uttrycket av ett enzym och nedreglera uttrycket av ett annat. Med vår plattform behöver du inte göra det, du behöver bara ställa in rätt förhållande mellan swarmbots."
"Den här tekniken är otroligt mångsidig, ", sa han. "Det är en förmåga vi vill dra nytta av."