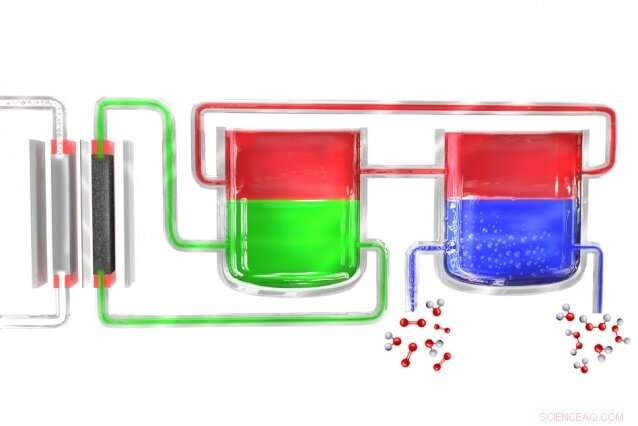
I en ny metod för att producera väteperoxid portabelt, en elektrolysör (vänster) delar upp vatten till väte och syre. Väteatomerna bildas initialt i ett elektrolytmaterial (grönt), som överför dem till ett medlarmaterial (rött), som sedan för dem till en separat enhet där mediatorn kommer i kontakt med syrerikt vatten (blått), där vätet kombineras med det för att bilda väteperoxid. Medlaren återvänder sedan för att börja cykeln igen. Kredit:Massachusetts Institute of Technology
Väteperoxid, ett användbart desinfektionsmedel för alla ändamål, finns i de flesta medicinskåp i den utvecklade världen. Men i avlägsna byar i utvecklingsländer, där det kan spela en viktig roll inom hälsa och sanitet, det kan vara svårt att komma förbi.
Nu, en process utvecklad vid MIT kan leda till en enkel, billig, bärbar enhet som kan producera väteperoxid kontinuerligt från bara luft, vatten, och el, tillhandahålla ett sätt att sterilisera sår, ytor för matlagning, och även vattenförsörjning.
Den nya metoden beskrivs denna vecka i tidskriften Joule i en artikel av MIT-studenter Alexander Murray, Sahag Voskian, och Marcel Schreier och MIT-professorerna T. Alan Hatton och Yogesh Surendranath.
Även vid låga koncentrationer, väteperoxid är ett effektivt antibakteriellt medel, och efter att ha utfört sin steriliseringsfunktion bryts den ner till vanligt vatten, i motsats till andra medel som klor som kan lämna oönskade biprodukter från dess produktion och användning.
Väteperoxid är bara vatten med en extra syreatom påklistrad - det är H2O2, istället för H2O. Det extra syre är relativt löst bundet, vilket gör det till en mycket reaktiv kemikalie som är angelägen om att oxidera andra molekyler runt den. Det är så reaktivt att det i höga koncentrationer kan användas som raketbränsle, och även koncentrationer på 35 procent kräver mycket speciella hanterings- och fraktprocedurer. Den typ som används som hushållsdesinfektionsmedel är vanligtvis bara 3 procent väteperoxid och 97 procent vatten.
Eftersom höga koncentrationer är svåra att transportera, och låga koncentrationer, är mest vatten, är oekonomiska att frakta, materialet är ofta svårt att få tag på på platser där det kan vara särskilt användbart, såsom avlägsna samhällen med orenat vatten. (Bakterier i vattenförsörjning kan effektivt kontrolleras genom att tillsätta väteperoxid.) Som ett resultat, många forskargrupper runt om i världen har strävat efter att utveckla någon form av bärbar utrustning för väteperoxidproduktion.
Det mesta av väteperoxiden som produceras i den industrialiserade världen tillverkas i stora kemiska fabriker, där metan, eller naturgas, används för att tillhandahålla en vätekälla, som sedan reageras med syre i en katalytisk process under hög värme. Denna process är energikrävande och inte lätt skalbar, kräver stor utrustning och en stadig tillförsel av metan, så det lämpar sig inte för mindre enheter eller avlägsna platser.
"Det finns ett växande samhälle som är intresserad av bärbar väteperoxid, " Surendranath säger, "på grund av uppskattningen att det verkligen skulle möta många behov, både på den industriella sidan såväl som när det gäller människors hälsa och sanitet."
Andra processer som hittills utvecklats för potentiellt bärbara system har viktiga begränsningar. Till exempel, de flesta katalysatorer som främjar bildningen av väteperoxid från väte och syre gör också mycket vatten, vilket leder till låga koncentrationer av den önskade produkten. Också, processer som involverar elektrolys, som denna nya process gör, har ofta svårt att separera den producerade väteperoxiden från elektrolytmaterialet som används i processen, återigen leder till låg effektivitet.
Surendranath och resten av teamet löste problemet genom att dela upp processen i två separata steg. Först, elektricitet (helst från solceller eller väderkvarnar) används för att bryta ner vatten till väte och syre, and the hydrogen then reacts with a "carrier" molecule. This molecule—a compound called anthroquinone, in these initial experiments—is then introduced into a separate reaction chamber where it meets with oxygen taken from the outside air, and a pair of hydrogen atoms binds to an oxygen molecule (O2) to form the hydrogen peroxide. I processen, the carrier molecule is restored to its original state and returns to carry out the cycle all over again, so none of this material is consumed.
The process could address numerous challenges, Surendranath says, by making clean water, first-aid care for wounds, and sterile food preparation surfaces more available in places where they are presently scarce or unavailable.
"Even at fairly low concentrations, you can use it to disinfect water of microbial contaminants and other pathogens, " Surendranath says. And, han lägger till, "at higher concentrations, it can be used even to do what's called advanced oxidation, " where in combination with UV light it can be used to decontaminate water of even strong industrial wastes, for example from mining operations or hydraulic fracking.
Så, till exempel, a portable hydrogen peroxide plant might be set up adjacent to a fracking or mining site and used to clean up its effluent, then moved to another location once operations cease at the original site.
In this initial proof-of-concept unit, the concentration of hydrogen peroxide produced is still low, but further engineering of the system should lead to being able to produce more concentrated output, Surendranath says. "One of the ways to do that is to just increase the concentration of the mediator, and fortunately, our mediator has already been used in flow batteries at really high concentrations, so we think there's a route toward being able to increase those concentrations, " han säger.
"It's kind of an amazing process, " han säger, "because you take abundant things, vatten, air and electricity, that you can source locally, and you use it to make this important chemical that you can use to actually clean up the environment and for sanitation and water quality."
"The ability to create a hydrogen peroxide solution in water without electrolytes, salt, bas, etc., all of which are intrinsic to other electrochemical processes, is noteworthy, " says Shannon Stahl, a professor of chemistry at the University of Wisconsin, som inte var involverad i detta arbete. Stahl adds that "Access to salt-free aqueous solutions of H2O2 has broad implications for practical applications."
Stahl says that "This work represents an innovative application of 'mediated electrolysis.' Mediated electrochemistry provides a means to merge conventional chemical processes with electrochemistry, and this is a particularly compelling demonstration of this concept. … There are many potential applications of this concept."
Den här historien återpubliceras med tillstånd av MIT News (web.mit.edu/newsoffice/), en populär webbplats som täcker nyheter om MIT-forskning, innovation och undervisning.