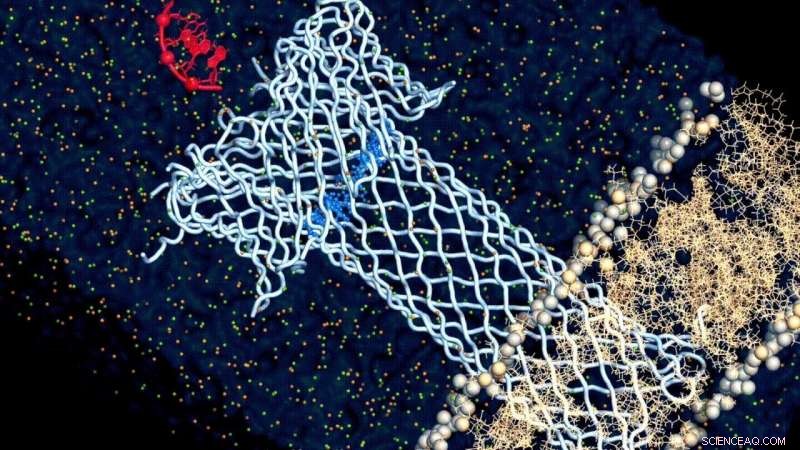
Kredit:Chan Cao, EPFL
Vissa typer av bakterier har förmågan att slå hål i andra celler och döda dem. De gör detta genom att släppa ut specialiserade proteiner som kallas "porbildande toxiner" (PFT) som fäster på cellens membran och bildar en rörliknande kanal som går genom den. Denna struktur över membranet kallas en por. Punkterad av flera PFT, målcellen förstör själv.
Dock, PFT har fått mycket intresse utöver bakterieinfektioner. De nanostora porerna som de bildar används för att känna av biomolekyler:En biologisk molekyl, t.ex., DNA eller RNA, passerar genom nanoporen som en sträng som styrs av en spänning, och dess individuella komponenter (t.ex. nukleinsyror i DNA) ger ut distinkta elektriska signaler som kan läsas ut. Faktiskt, nanoporavkänning finns redan på marknaden som ett viktigt verktyg för DNA- eller RNA-sekvensering.
Publicerar i Naturkommunikation , forskare ledda av Matteo Dal Peraro vid EPFL har studerat en annan stor PFT som kan användas effektivt för mer komplex avkänning, såsom proteinsekvensering. Giftet är aerolysin, som produceras av bakterien Aeromonas hydrophila, och är den "grundande medlemmen" av en stor familj av PFT som finns i många organismer.
En av de främsta fördelarna med aerolysin är att det bildar mycket smala porer som kan skilja molekyler från varandra med mycket högre upplösning än andra toxiner. Tidigare studier har visat att aerolysin kan användas för att "känna" flera biomolekyler, men det har gjorts få studier om sambandet mellan aerolysins struktur och dess molekylära avkänningsförmåga.
Forskarna använde först en strukturell modell av aerolysin för att studera dess struktur med datorsimuleringar. Som ett protein, aerolysin består av aminosyror, och modellen hjälpte forskarna att förstå hur dessa aminosyror påverkar funktionen av aerolysin i allmänhet.
När de väl hade ett grepp om förhållandet, forskarna ändrade strategiskt aminosyror i datormodellen. Modellen förutspådde sedan den möjliga inverkan av varje förändring på den övergripande funktionen av aerolysin.
I slutet av beräkningsprocessen, Dr Chan Cao, den ledande författaren till detta verk, producerade 16 genetiskt modifierade, "mutanta" aerolysinporer, bäddade in dem i lipiddubbelskikt för att simulera deras position i ett cellmembran, och utförde olika mätningar (enkanalsinspelning och molekylära translokationsexperiment) för att förstå hur jonkonduktans, jonselektivitet, och translokationsegenskaper hos aerolysinporen regleras på molekylär nivå.
Och med detta tillvägagångssätt, forskarna hittade till slut vad som driver förhållandet mellan strukturen och funktionen av aerolysin:dess lock. Aerolysinporen är inte bara ett rör som går genom membranet, men har också en lockliknande struktur som attraherar och binder målmolekylen och "drar" den genom porens kanal. Och studien fann att det är elektrostatiken vid denna lockregion som dikterar detta förhållande.
"Genom att förstå detaljerna i hur strukturen av aerolysinporen ansluter till dess funktion, vi kan nu konstruera anpassade porer för olika avkänningsapplikationer, " säger Dal Peraro. "Dessa skulle öppna nya, outforskade möjligheter att sekvensera biomolekyler som DNA, proteiner och deras post-translationella modifieringar med lovande tillämpningar inom gensekvensering och biomarkördetektion för diagnostik." Forskarna har redan lämnat in ett patent för sin sekvensering och karakterisering av de genetiskt modifierade aerolysinporerna.