Brown University -forskare har visat att effekterna av yttre belastning på en katalysator beror på den inre belastningen som utövas av kemiska reaktanter. Det nya teoretiska ramverket kan vara användbart för att optimera katalysatorer för olika reaktioner. Upphovsman:Peterson lab / Brown University
Brown University -forskare har utvecklat en ny teori för att förklara varför sträckning eller komprimering av metallkatalysatorer kan få dem att prestera bättre. Teorin, beskrivs i tidningen Naturkatalys , kunde öppna nya designmöjligheter för nya katalysatorer med nya möjligheter.
Katalysatorer är ämnen som påskyndar kemiska reaktioner. De allra flesta industriella katalyserna innefattar fasta ytor, ofta metaller, som katalyserar reaktioner i vätskor eller gaser. En katalysator på en bil, till exempel, använder metallkatalysatorer för att plocka ut gifter ur avgaser. Det finns också intresse för att använda metallkatalysatorer för att omvandla koldioxid till bränslen, göra gödselmedel från atmosfäriskt kväve och driva reaktioner i bränslecellsbilar.
Forskning under de senaste åren har visat att applicering av en belastning på metallkatalysatorer - antingen kompression eller spänning - i vissa fall kan förändra hur de fungerar.
"Stam är ett riktigt hett ämne inom katalys just nu, "sa Andrew Peterson, en biträdande professor i Brown's School of Engineering och medförfattare till forskningen. "Vi har börjat se saker som händer under påfrestningar som inte lätt förklaras av den traditionella teorin om hur katalysatorer fungerar. Det fick oss att tänka på ett alternativt ramverk för denna fråga."
En metallkatalysator verkar genom att få reaktanter att binda till dess yta, en process som kallas adsorption. Adsorption bryter kemiska bindningar av reaktantmolekylerna, möjliggör att olika stadier av en kemisk reaktion kan äga rum på metallens yta. När reaktionsstegen är slutförda, slutprodukten frigörs från katalysatorn genom omvänd process, kallas desorption.
En katalysators nyckelegenskap är dess reaktivitet, vilket betyder hur tätt den binder kemiska molekyler till dess yta. Katalysatorer måste vara något reaktiva för att bindning ska ske, men inte för reaktivt. För mycket reaktivitet gör att katalysatorn håller för hårt i molekylerna, vilket kan hindra vissa steg i reaktionen eller göra det så att slutprodukterna inte kan desorbera.
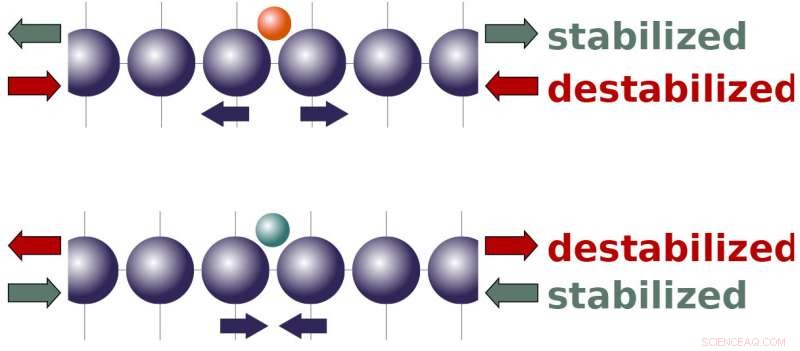
Det har visat sig de senaste åren att applicering av en stam på en katalysator kan justera dess reaktivitet, och det finns en väletablerad teori för hur det fungerar. Generellt, teorin förutsäger att dragspänning bör öka reaktiviteten, medan komprimering bör minska den. Dock, Peterson och hans grupp stötte hela tiden på system som inte lätt förklaras av teorin.
Det fick forskarna att tänka på ett nytt sätt att se problemet. Den traditionella teorin beskriver saker på nivån av elektroner och elektronband. Den nya teorin zoomar ut lite, fokuserar istället på mekaniken för hur molekyler interagerar med en katalysators atomgitter.
Peterson och hans team visade att molekyler bundna till en katalysators yta tenderar att antingen trycka isär atomer i gallret eller dra dem närmare varandra, beroende på molekylernas egenskaper och bindningsställena. De olika krafter som produceras av molekyler har intressanta konsekvenser för hur yttre belastning bör påverka en katalysators reaktivitet. Det tyder på att spänning, som sträcker en katalysators atomgitter, bör göra en katalysator mer reaktiv mot molekyler som naturligtvis vill skjuta isär gallret. På samma gång, spänning bör minska reaktiviteten för molekyler som vill dra ihop gallret. Komprimering - klämning av gallret - har en omvänd effekt.
Den nya teorin hjälper inte bara till att förklara tidigare förbryllande resultat, det gör viktiga nya förutsägelser. Specifikt, den förutsäger ett sätt att bryta traditionella skalningsförhållanden mellan katalysatorer och olika typer av molekyler.
"Skalningsförhållanden betyder att, under normala omständigheter, när du ökar katalysatorns reaktivitet för en kemikalie, det ökar reaktiviteten för andra kemikalier också, "Sa Peterson." På samma sätt om du minskar reaktiviteten för en kemikalie, du minskar det för andra. "
Dessa skalningsrelationer orsakar besvärliga avvägningar när man försöker optimera en katalysator. Att få perfekt reaktivitet för en kemikalie kan få en annan kemikalie att binda för hårt (eller för löst), potentiellt hämmar vissa reaktionsstadier. Men denna nya teori antyder att påfrestning kan bryta dessa skalningsförhållanden - vilket gör att en katalysator samtidigt kan binda en kemikalie tätare och en annan mer löst, beroende på kemikaliens naturliga interaktion med katalysatorns atomgitter och hur töjningsfältet konstrueras på katalysatorytan.
"Nu kan du börja tänka på riktigt finjusterande katalysatorer för att prestera bättre under olika reaktionssteg, "Sa Peterson." Det kan dramatiskt förbättra katalysatorns prestanda, beroende på vilka kemikalier det handlar om. "
Petersons team har börjat sammanställa en databas med vanliga reaktionskemikalier och deras interaktioner med olika katalysatorytor. Den databasen kan fungera som en vägledning för att hitta reaktioner som kan dra nytta av påfrestningar och bryta skalningsförhållanden.
Sålänge, Peterson hoppas att det arbete de har gjort hittills kommer att ge den katalysgemenskapen ett nytt sätt att tänka på påfrestningar.
"Vi försöker ge ett ramverk som ger en mer intuitiv förståelse för hur stam fungerar i katalys, "Sa Peterson." Så när människor konstruerar nya katalysatorer, de kan tänka på sätt att bättre utnyttja dessa belastningseffekter. "