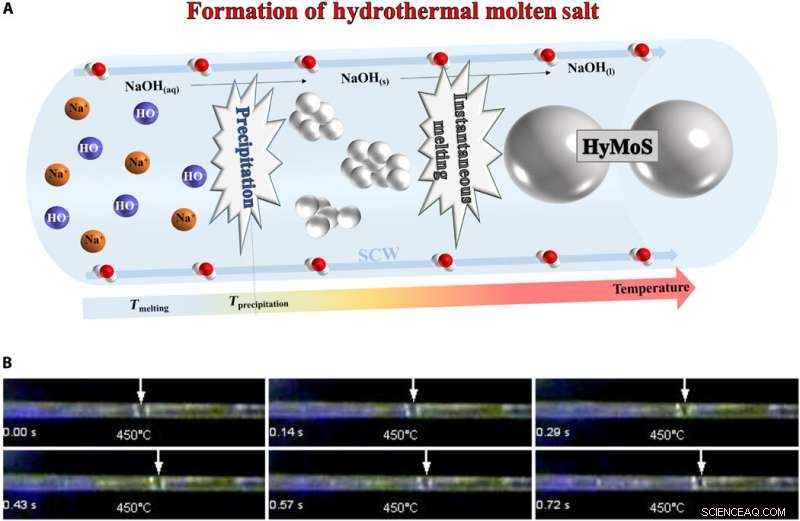
Bildandet av HyMoS. (A) Schema för bildandet av HyMoS i SCW, med exemplet NaOH. (B) Monteringsbild från film S1 (nedan) som visar direkt observation och rörelse av en NaOH-smält saltdroppe i en safirkapillär vid 25 MPa och 450 °C. Fotokredit:Thomas Voisin, ICMCB. Kredit:Science Advances, doi:10.1126/sciadv.aaz7770
I en ny rapport om Vetenskapens framsteg , T. Voisin och ett forskarteam i Scientific Research National Centre och Institute of Technology and Energy Management i Frankrike, föreslagit ett nytt lösningsmedelssystem. Det hydrotermiska smältsaltsystemet (HyMoS), består av ett smält salt i trycksatt vatten och kan ändra lösligheten av oorganiska ämnen i superkritiskt vatten. Forskarna använde natriumhydroxid (NaOH); ett salt med låg smälttemperatur, och visade förmågan att fälla ut den vid en temperatur över dess smältpunkt, för att omedelbart bilda HyMoS. Det smälta saltet kunde sedan lösa upp en stor mängd oorganiskt salt inklusive natriumsulfat (Na 2 SÅ 4 ). Lösningsmedelssystemet öppnar en ny väg inom olika områden inklusive materialsyntes, biomassaomvandling, grön kemi, återvinning, katalys och hållbar tillverkning. Arbetet erbjuder möjligheter bortom hydrotermisk dynamik för att undersöka kemin och insikterna i innovativ saltutfällning.
Superkritiskt vatten är ofta känt som ett "magiskt" lösningsmedel, på grund av dess förmåga att lösa upp olja. Denna egenskap har vidgat de potentiella tillämpningarna för SCW i materialsyntes, återvinning eller omvandling av biomassa. Dock, när polariteten för SCW bryts ner, lösligheten av de oorganiska föreningarna minskar. Utmaningen kan lösas genom att identifiera bra hjälplösningsmedelskandidater med stor upplösningsförmåga för oorganiska föreningar tillsammans med hög termisk stabilitet, för att övervinna gränserna för SCW. Smälta salter är en attraktiv möjlighet på grund av deras höga densitet och viktiga upplösningsförmåga. Smälta salter är mycket olika och används rikligt i årtionden som nitratsalter, karbonater, hydroxider eller eutektiska blandningar för att lösa upp oorganiska material. I det här arbetet, Voisin et al. föreslagit att generera smält salt inom SCW för att övervinna gränserna för SCW enbart. De komponerade det hydrotermiska smälta saltet (HyMoS) med ett salt av intresse tillsammans med SCW, för hydrotermiska applikationer vid hög temperatur.

Video av observationen av en NaOH-H2O-blandning vid 25 MPa och 450°C i ett safirrör. Videon visar rörelsen av den smälta NaOH-droppen inuti kapillären i vatten. Kredit:Science Advances, doi:10.1126/sciadv.aaz7770
För HyMoS-bildning, teamet injicerade en homogen elektrolytvatten/saltlösning under tryck och värmde upp den för att saltet skulle falla ut. Eftersom nederbördstemperaturen var högre än smälttemperaturen, fusion av saltet följde omedelbart utfällning, att bilda HyMoS. Forskarna noterade utvecklingen och rörelsen av en smält NaOH-droppe i SCW i en safirkapillär. När de kylt ner systemet, de kunde återvinna den initiala homogena elektrolyten vatten/saltlösning, eftersom mekanismen var helt reversibel. Voisin et al. valde NaOH-saltet för dess höga termiska stabilitet och låga smälttemperatur (318 0 C) och hög kapacitet att lösa oorganiska salter.
Teamet använde en experimentell uppsättning, detaljerad på annat håll, att mäta löslighetsvärdena och studera beteendet hos natriumhydroxid i SCW. De undersökte skillnaden i densitet och viskositet mellan de två komponenterna för att mäta lösligheten av föreningen under SCW-förhållanden. Tvåstegsmekanismen för fast utfällning var snabb, och inga fasta partiklar observerades i safirkapillärutrustningen utrustad med en konventionell laddningskopplad kamera med 50 bilder per sekund. Resultaten visade på genomförbarheten av att skapa ett tätt hjälplösningsmedel som flödar längs med SCW. Teamet fokuserade sedan på förmågan hos NaOH att lösa upp andra oorganiska salter under SCW-förhållanden.
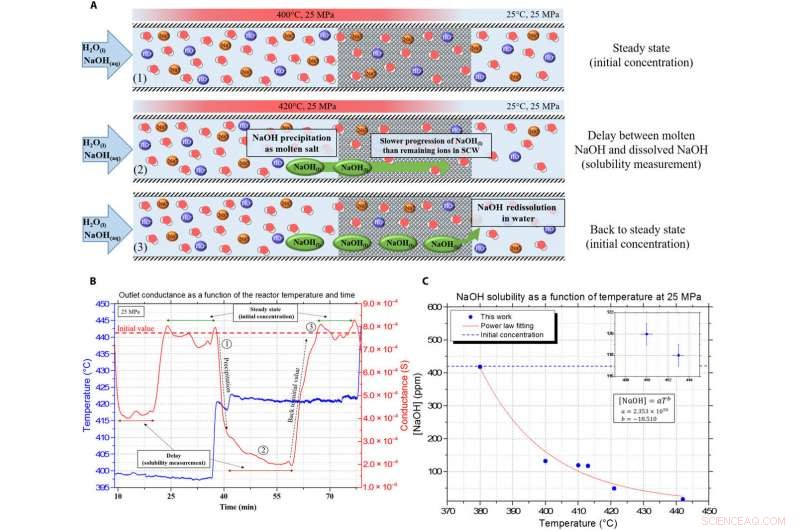
Presentation av kontinuerlig konduktivitetsdata och fördröjningen, används för att mäta lösligheten av NaOH-smälta salt. (A) Illustration av mätprincipen med användning av fördröjningsanalys på grund av skillnaderna i viskositet och densitet i det porösa mediet mellan NaOH och SCW. (B) Exempel på den kontinuerliga mätningen som erhålls med fördröjningsprincipen, med den blå kurvan som temperaturen inuti reaktorn och den röda linjen är konduktansmätningen vid utloppet (korrigerat från tidsfördröjningen). (C) Resulterande NaOH-löslighetskurva i SCW vid 25 MPa. Kredit:Science Advances, doi:10.1126/sciadv.aaz7770
För att markera förmågan för NaOH-baserad HyMoS att lösa upp ett fast salt i SCW, teamet föreslog ett annat experimentellt protokoll. Under experimentet, de injicerade först en vattenlösning av det oorganiska saltet natriumsulfat (Na 2 SÅ 4 10 ) in i systemet vid en given temperatur för att avsätta det fasta saltet på reaktantväggen. Eftersom Voisin et al. kände till lösligheten av Na 2 SÅ 4, de kontrollerade om nederbörd förekom i systemet under kontinuerliga mätningar av konduktivitet. Forskarna beräknade koncentrationen av natriumsulfat i natriumhydroxidlösningen. Även om den ökande temperaturen i installationen hade liten inverkan på det oorganiska saltet natriumsulfat, den initiala koncentrationen av det smälta saltet natriumhydroxid var en stor inverkan på dess upplösningshastighet. Helt logiskt därför när koncentrationen av natriumhydroxid ökade, dess motsvarande smälta fas ökade också i installationen, vilket orsakar högre upplösningshastigheter av oorganiska salter avsatta i reaktorn för att säkerställa kontinuerligt flöde.
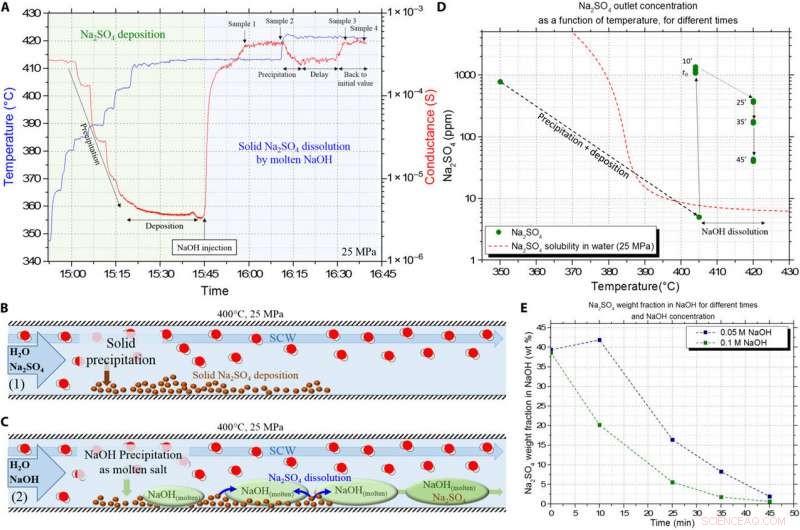
Validering av upplösningen av det avsatta Na2SO4 fasta saltet av NaOH HyMoS i SCW i kontinuerligt flöde. (A) Rå konduktans (i rött) och temperatur (i blått) signaler erhållna från experimentuppställningen, som visar de olika stegen i protokollet. Grön zon representerar Na2SO4-utfällningen och saltavsättningssteget in i reaktorn, och blå zon representerar injektionen av NaOH-lösning för att lösa det avsatta saltet. (B) Schema som illustrerar det första steget i experimentet bestående av saltavsättning genom utfällning. (C) Schema som illustrerar det andra steget i experimentet, med utfällning/smältning av NaOH och upplösning av den tidigare avsatta Na2S04. (D) Na2SO4 ICP-koncentration resultat enligt temperaturen, under olika tider under upplösningen med NaOH. Jämförelse mellan mätningarna och den normala lösligheten av Na2SO4 i SCW. (E) Utveckling av Na2SO4-massfraktionen i den smälta NaOH-fasen med tiden, för två olika NaOH-inmatningskoncentrationer. Kredit:Science Advances, doi:10.1126/sciadv.aaz7770
På det här sättet, T. Voisin och kollegor observerade smält salt i SCW för att ta itu med de befintliga utmaningarna med superkritisk vätskebaserad teknologi. Med användning av ett stabilt smält hydroxidsalt såsom natriumhydroxid genererade de ett in situ lösningsmedel för att lösa upp en stor mängd av det fasta natriumsulfatsaltet. Forskarna demonstrerade den första tillämpningen av HyMoS och kringgick saltavsättning och obstruktion i reaktorerna för att utveckla kontinuerliga flödesprocesser. Tekniken är kostnadseffektiv, eftersom basiska salter som NaOH som används i experimenten är relativt billiga material, jämfört med komplexa joniska vätskor. Förmågan att generera ett tätt lösningsmedel med ett enkelt och billigt system har också inverkan på hydrotermiska system. Smälta salter är, dock, begränsad i förhållande till bearbetbarheten för kontinuerliga system på grund av den höga temperatur och höga viskositet som krävs i batchsystem. Det tvåfasiska HyMoS-systemet består av SCW och ett smält salt, och upplägget kan utforskas som en ny typ av hydrotermisk vatten/salt-emulsion för att effektivt lösa upp en mängd olika salter.
© 2020 Science X Network