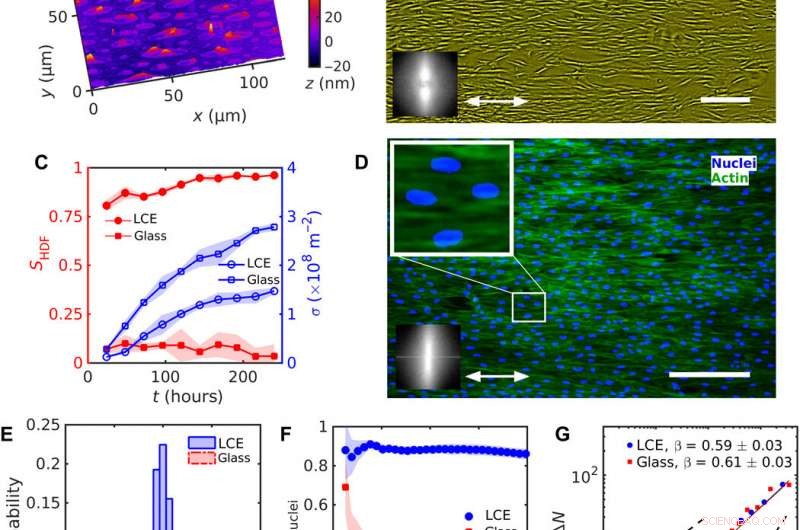
Enhetlig inriktning av HDF-celler på LCE med en enhetlig nˆLCE=konst. (A) Digital holografisk mikroskopi (DHM) textur av LCE-ytan efter kontakt med det vattenhaltiga tillväxtmediet. (B) Faskontrastmikroskopi (PCM) textur av HDF-celler som växer på LCE-substrat 120 timmar efter sådd. Dubbelhövdad pil representerar nˆLCE. (C) Utveckling av ordningsparametern SHDF för cellkroppar (fyllda röda symboler) och celldensitet σ (tomma blå symboler). (D) Fluorescerande mikroskopiska texturer av HDF-celler på LCE; fluorescensmärkta kärnor (blå) och cytoskelett F-aktinproteiner (gröna). Förstorad textur visar långsträckta kärnor orienterade i samma riktning som cellernas kroppar. Insättningar i (B) och (D) visar snabb Fourier-transformation av (B) PCM och (D) fluorescerande F-aktin-texturer som indikerar orienteringsordning längs den enhetliga nˆLCE. (E) Fördelning av kärnornas orientering. (F) Beroende av ordningsparametern Snuclei av kärnor på storleken på ett kvadratiskt underfönster. (G) Antal densitetsfluktuationer ΔN beräknat för medelantalet cellkärnor 〈N〉. Skala staplar, 300 μm. Kredit:Science Advances, doi:10.1126/sciadv.aaz6485
Eukaryota celler i levande vävnader kan påverka viktiga fysiologiska processer som apoptos och cellmigration baserat på dynamisk mönsterbildning med rumsligt varierande orienteringar. Dock, det är ändå utmanande att projicera en fördesignad karta över orienteringsordningen på en växande vävnad i labbet. I en ny studie nu publicerad på Vetenskapens framsteg , Taras Turiv och ett forskarlag i kemisk fysik, avancerade material och biomedicinska vetenskaper vid Kent State University, Ohio, U.S., detaljerade ett nytt tillvägagångssätt för att producera cellmonoskikt av humana dermala fibroblaster. De förutformade orienteringsmönstren och topologiska defekter med hjälp av en fotojusterad flytande kristallelastomer (LCE) som svällde anisotropiskt i ett vattenhaltigt medium. Teamet skrev in mönstren i LCE, och vävnadsmonoskiktet replikerade mönstren för att orsaka starka variationer i cellfenotyper (storlek och form), deras ytdensitet och taldensitetsfluktuationer. Den nya metoden kan kontrollera det kollektiva beteendet hos celler i levande vävnader under celldifferentiering och vävnadsmorfogenes för breda tillämpningar inom bioteknik och regenerativ medicin.
Celler som utgör levande vävnader uppvisar ofta orienteringsordning när de är i nära kontakt på grund av ömsesidig inriktning av anisometriska celler. Riktningen för den genomsnittliga orienteringen kan variera i rum och tid för att producera topologiska defekter som kallas disklinationer. Sådana defekter kan röra sig i vävnaden för att spela en viktig roll under kompressions-dilatativa påfrestningar och processer, inklusive utvinning av döda celler. Förmågan att designa en vävnadsställning av levande celler med orienteringsordning och kontroll är viktig för biomedicinska forskare för att undersöka och manipulera levande materia. Forskare har redan producerat beställda cellenheter på litografiskt tillverkade ytor, inklusive kanterna på mikrokanaler, i mikrospår och ytor med materialstyvhetsgradienter. I det här arbetet, Turiv et al. designade vävnader med en hög grad av orienteringsordning och förutbestämd rumsligt varierande riktning, baserat på en mall av regissörsmönster på LCE-substrat. Teamet använde humana dermala fibroblastceller (HDF) som byggnadsenheter för den mallade vävnaden.
Materialkorn fungerar som en styrskena för HDF-celler. Kredit:Science Advances, doi:10.1126/sciadv.aaz6485
Fibroblaster är de vanligaste däggdjursbindvävscellerna och de bibehåller vanligtvis en platt långsträckt form med viktiga roller under vävnadsreparation och omstrukturering, samt sårläkning. Forskare kan programmera om dessa celler till pluripotenta stamceller för lovande tillämpningar inom diagnostik och terapi. I det här arbetet, de kombinerade effekterna av cellsådd och delning av mönstrade HDF-vävnader på fördesignade LCE-substrat gav sammanflytande vävnader. Den strukturerade LCE hade en markant inverkan på vävnaden, där de kontrollerade inriktningsmönstret och den rumsliga fördelningen av celler, deras täthet, fluktuationer, och fenotyp. Den mönstrade LCE:n visade placeringar av topologiska defekter i vävnader genom anisotropa ytinteraktioner på förutbestämda platser. Eftersom den cellulära inriktningen och topologiska defekterna kan styra biokemiska processer i mikroskala, detta arbete öppnar möjligheten att konstruera ytor för kontrollerad vävnadsmönstring för att designa dem för specifika funktioner.
Under experimenten, Turiv et al. stödde LCE-substratet av en glasplatta och täckte det med indiumtennoxid (ITO) för att minska ytjämnheten, följt av beläggning av ett skikt av fotokänsligt azofärgämne och täckte slutligen substratet med ett vattenhaltigt medium av cellkultur. Ytkornen på materialet fungerade som en styrskena för HDF-celler. När HDF-cellerna suspenderades i cellkultur, de verkade runda men efter att ha satt sig i underlaget, de utvecklade ett långsträckt utseende. Forskarna registrerade sammanflöde (tillväxt) resultat från kombinerade effekter av cellsådd. Resultaten visade att orienteringsordningen inträffade på grund av direkta interaktioner mellan celler och LCE-substratet. Substraten hjälpte till att anpassa både kroppar och kärnor av HDF-celler som en viktig egenskap för många cellfunktioner inklusive proteinuttryck, rörlighet, metabolism och differentiering.

Mönstrad inriktning av HDF-celler på LCE med en (−1/2, +1/2) par defekter. (A) PolScope-textur som visar nˆLCE och optisk retardation av LCE i kontakt med celltillväxtmediet. (B och C) DHM-texturer av LCE-yta i kontakt med celltillväxtmediet med (B) -1/2 och (C) +1/2 defekter. (D) Fluorescensfärgade HDF-celler; 4′, 6-diamidino-2-fenylindol-märkta cellkärnor (blå) och falloidin-märkta aktincytoskelettfilament (gröna). (E) Ytdensiteten hos cellkärnor σ som funktionen av avståndet r från +1/2 (blå) och -1/2 (röd) defekta kärnor. (F) Stora taldensitetsfluktuationer ΔN av kärnorna i närheten av defekta kärnor. (G) PCM-bilder av HDF-celler på LCE-substrat 240 timmar efter sådd. Blå och röda prickar anger placeringen av +1/2 och −1/2 defekta kärnor, respektive, erhållen från polariserad optisk mikroskopi (POM) textur av LCE. (H) Färgkodat orienteringsfält och (I) motsvarande schema för mönstrad HDF-vävnadsdirektör n HDF avbildad med PCM. Röda staplar i (I) anger lokal orientering av cellernas långa axlar. (J) Separation mellan halvstyrka defekter för horisontell och vertikal riktning mellan dem (se fig. S6). Skala staplar, 300 μm. Kredit:Science Advances, doi:10.1126/sciadv.aaz6485
HDF-cellerna på LCE organiserade sig själv till inriktade sammansättningar enligt förutbestämda anvisningar. Teamet noterade att beteendet hos celler och celldensitet varierade när de närmade sig defekta kärnor och andra topologiska inkonsekvenser (defekter av böjd typ eller defekter av spridningstyp) på LCE-substraten. The substrates markedly impacted the HDF cells that were in contact with each other, resulting in collectively strong differences in the size and shape of cells. The marked differences indicated the influence of the predesigned patterns on the HDF cell phenotype (size and shape). Based on additional results, Turiv et al. credited the number density fluctuations in tissues to be influenced by the surface charge of director patterns and studied the issue in detail in a larger surface area.
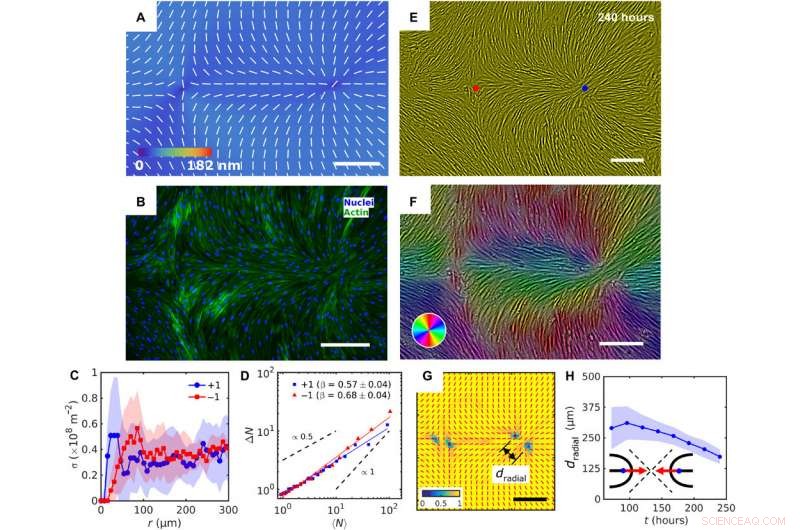
Patterned alignment of HDF cells on LCE predesigned with a pair of −1 and radial +1 (splay type) defects. (A) PolScope image of nˆLCE pattern of LCE in contact with the cell growth medium. (B) Fluorescently labeled HDF cells. (C) The surface density of cell nuclei σ as the function of distance from defect cores. (D) Large number density fluctuations ΔN with mean number of nuclei 〈N〉 showing a larger slope near −1 cores as compared to +1. (E) PCM textures of HDF cells on LCE layer at 240 hours after cell seeding. Red and blue dots denote location of −1 and +1 defects in patterned LCE obtained from crossed polarized textures. (F) Color-coded orientational field and (G) of the corresponding scheme of patterned HDF tissue director nˆHDF obtained from local anisotropy of PCM texture in (E). Red bars in (G) denote local orientation of cells’ long axes. (H) Time dependence of separation between two +1/2 defects near the +1 radial core. Skala staplar, 300 μm. Kredit:Science Advances, doi:10.1126/sciadv.aaz6485
På det här sättet, Taras Turiv and colleagues showed the dynamics and propagation of defects in patterned tissues and how they could be halted through surface anchoring forces. The scientists used LCE substrates with photopatterned structures of varying molecular orientations to grow biological tissues with predesigned cell alignment. The substrates affected cell alignment as well as cell surface density and cell phenotypes. The team noted higher density of cells in defect cores with positive topological charge, while cell density was lower near negative defects. The cells mechanistically aligned to the substrates by swelling upon contact with the aqueous cell culture medium, followed by aligning to predesigned photopatterned direction. This approach will allow materials scientists and bioengineers to design biological tissues with predetermined cell alignment and precise location of orientational defects. The outcomes can facilitate controlled cell migration, differentiation. and apoptosis. The work can be further optimized to advance the understanding of fundamental mechanisms underlying tissue development and regeneration.

The orientational order of the assemblies in +1/2 and −1/2 disclinations. Kredit:Science Advances, doi:10.1126/sciadv.aaz6485
© 2020 Science X Network