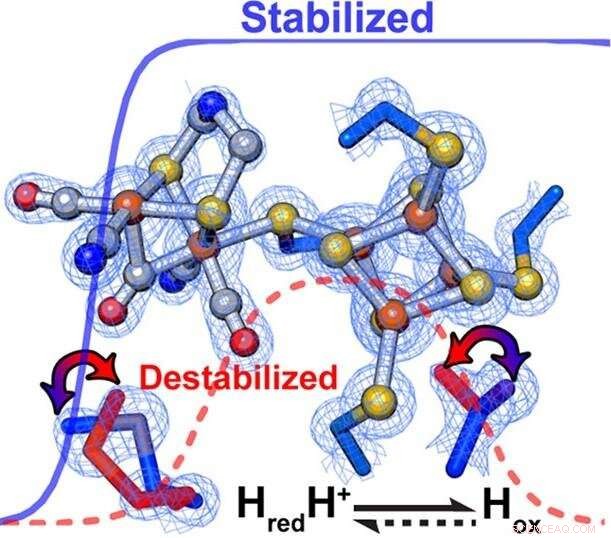
Forskare fann att subtila förändringar i proteinställningen som omger ett enzyms katalytiska centrum utsökt styr hastigheten och riktningen av kemiska reaktioner. Inom [FeFe]-hydrogenaser, sekundära interaktioner påverkade direkt den relativa stabiliseringen/destabiliseringen av olika oxidationstillstånd av metallklustret på det aktiva stället. Kredit:PNNL
När forskare letar efter sätt att utveckla och förbättra vardagsprodukter, allt från bränsle till mediciner, enzymer ger naturens exempel på den kontroll som behövs för att få kemiska reaktioner att fungera på önskade sätt. Men ett fenomen som kallas katalytisk bias fortsätter att störa forskare.
Proteinställningen runt ett enzyms katalytiska kärna kontrollerar utsökt reaktivitet, inklusive riktningen och hastigheten för kemiska processer. Forskare hänvisar till denna finjustering som "katalytisk bias" - och hur det uppstår förblir allmänt debatterat.
Mysteriet är ett steg närmare att lösas.
En forskargrupp från tre nationella laboratorier vid det amerikanska energidepartementet (DOE) och fyra universitet fann att subtila förändringar i miljön kring vissa enzymer inte bara kan förändra hastigheten på en cellulär reaktion med häpnadsväckande sex storleksordningar utan också dess riktning. Den vändningen - roten till det katalytiska bias-dilemmat - är som att köra fort i en riktning med 10 miles per sekund, går sedan i motsatt riktning vid 1, 000, 000 miles per sekund. Gapet ökar snabbt.
"Beroende på det önskade resultatet, partiskheten kan vara oöverstiglig eller en av de bästa sakerna som någonsin hänt, sa Simone Raugei, en beräkningsforskare vid PNNL och medförfattare till studien. "En reaktion kan ha många mellanprodukter och kan ta flera vägar - vissa mer effektiva än andra. Så att kunna ställa in katalysatormiljön kan göra en anmärkningsvärd skillnad i reaktionshastigheten."
Resultaten, redovisas i Journal of the American Chemical Society , har betydande konsekvenser för utformningen av syntetiska katalysatorer som används i industriella miljöer, där det är avgörande att förutsäga och kontrollera beteendet hos en reaktion. Resultaten ger också en större grundläggande förståelse för de faktorer som styr metabola processer i allt liv.
Katalytisk bias i metalloenzymer
I naturen, mikroben Clostridium pasteurianum (Cp) producerar flera järnbaserade enzymer, [FeFe]-hydrogenaser, som tillhör en stor grupp metalloenzymer. Metalloenzymer är involverade i en mängd reaktioner som fyller många funktioner, som att flytta väte genom mikrobiella samhällen, fånga kväve från luften, producerar metan, och omvandling av kolhydrater.
Mångsidigheten gör att metalloenzymer, och [FeFe]-hydrogenaser specifikt, idealiska ämnen för att utforska grundläggande frågor relaterade till kemiska omvandlingar. Faktiskt, hydrogenaser har varit inspirationskällan för många studier av elektrokatalys i energiomvandlingsreaktioner finansierade genom DOE:s Office of Basic Energy Sciences, sa Morris Bullock, chef för Center for Molecular Electrocatalysis, ett DOE Energy Frontier Research Center.
"Upptäckter som rapporterats av olika forskargrupper med hjälp av kompletterande tillvägagångssätt berikar vår förståelse av den grundläggande vetenskapliga grunden för katalys av både biologiska och molekylära system, " sa Bullock.
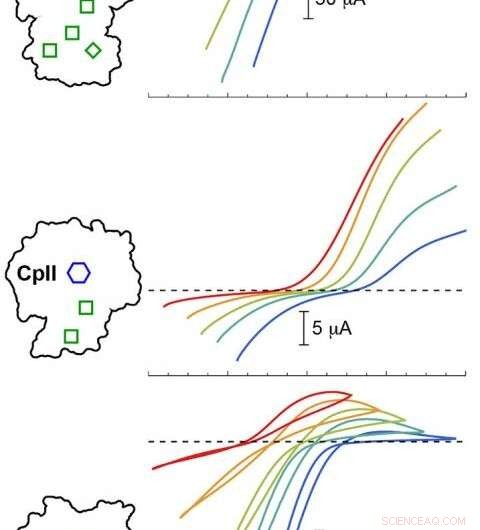
PNNL beräkningsmodellering validerade experiment med tre Cp-hydrogenaser vid olika pH-värden. Resultaten visade att den katalytiska potentialen (färgade kurvor) varierade beroende på arrangemanget av H-klustret (blå hexagon) och tillbehörsklustren (gröna lådor). Färgade spår under den streckade linjen motsvarar väteproduktion, medan spår ovanför den streckade linjen motsvarar väteoxidation. Kreditera: J. Am. Chem. Soc . 2020, 142, 3, 1227-1235
PNNL gemensamt utnämnd John Peters är professor vid Washington State University (WSU) och chef för biologisk och elektronöverföring och katalys, ett annat DOE Energy Frontier Research Center. Peters började studera [FeFe]-hydrogenaser i slutet av 1990-talet med hjälp av enzymer som finns i Cp-mikroben. Men de tidigare studierna fokuserade på allmänna mekanistiska aspekter, och först nyligen har forskare börjat tänka på enzymer i samband med katalytisk bias.
Peters och Paul King, chef för Physical Biochemistry and Photosynthesis Group vid National Renewable Energy Laboratory (NREL), designade den nya studien tillsammans med Raugei vid PNNL och Anne Jones, en docent vid School of Molecular Sciences vid Arizona State University (ASU).
Studien syftade till att identifiera hur tre [FeFe]-hydrogenaser skiljer sig åt när det gäller att kontrollera både protonreduktion till molekylärt väte, såväl som den omvända reaktionen - oxidation av molekylärt väte till protoner. Varje så kallad redoxreaktion spelar en avgörande roll i biologisk energiöverföring och har studerats omfattande för energilagring och energiproduktion.
Elektrostatik finjusterar reaktionsmellanprodukter
Studien av katalytisk aktivitet av de tre [FeFe]-hydrogenaserna involverade en kraftfull kombination av experimentella tillvägagångssätt vid ett flertal forskningsanläggningar och utförda av forskare från WSU, NREL och ASU. Raugei, också en gemensam utnämning vid WSU, ledde det teoretiska och beräkningsmodelleringsteamet, vars uppgift var att reda ut de experimentella observationerna och utveckla en teoretisk modell för den enzymatiska mekanismen.
Forskargruppen använde exakta mätningar från röntgenstrålar vid Linac Coherent Light Source-anläggningen, belägen vid Stanford Synchrotron Radiation Lightsource, att analysera enzymets atomstruktur. Nästa, forskare vid ASU utsatte enzymet för en elektrisk ström för att undersöka den elektrokatalytiska aktiviteten av varje hydrogenas i både vilande och aktivt tillstånd. Alla enzymer delade på ett identiskt katalytiskt kluster av järn- och svavelatomer – allmänt kallat H-kluster – men skilde sig åt i sammansättningen av den omgivande proteinmiljön.
Forskarna noterade signifikanta skillnader i reaktionsbias mellan de tre hydrogenaserna. Sedan, under återkopplingsslingor mellan experimenten och beräkningsmodellering, subtila förändringar i det elektrostatiska fältet runt det katalytiska centret fångade lagets uppmärksamhet.
"Vi såg verkligen att om fältet ändrades, vi kunde driva reaktionen mer fördelaktigt på ett eller annat sätt för att försöka förklara den experimentella observationen, " sa Raugei. De subtila skillnaderna i miljön, han sa, bestämde reaktionsriktningen under steady state-betingelser och finjusterade reaktionshastigheten.
Enligt Kungl. den selektiva stabiliseringen eller destabiliseringen av katalytiska mellanprodukter främjade företrädesvis väteoxidation eller protonreduktion. Specifikt, en mer hydrofob miljö som omger H-klustret trimmade enzymet för att gynna väteproduktion, medan väteoxidation gynnades av en mindre hydrofob miljö.
"Detta jobb, sade kungen, "avslöjar biologins kraft att kontrollera reaktiviteten hos metalloenzymer för att möta de unika metaboliska processerna i allt liv och ger värdefull ny insikt för utformningen av förbättrade elektrokatalytiska plattformar."
Peters sa att designegenskaperna som [FeFe]-hydrogenaser använder för att ställa in och kontrollera reaktivitet sannolikt delas med andra biokatalysatorer på metallplatsen. Forskarna planerar att förfina sin modell för att ge en mer allmän plan för att förstå katalytisk bias i den större klassen av redoxenzymer - och den metaboliska energin som driver allt liv.