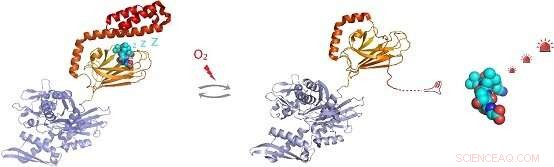
Figur:Under oxidativ stressförhållanden, den molekylära chaperonen Hsp70 genomgår post-translationell modifiering av cysteinrester genom tillsats av tripeptiden glutation. Glutationionylering inom den substratbindande domänen hos Hsp70 får den C-terminala spiralformade regionen i Hsp70 att riva upp och uppta sitt eget substratbindningsställe. Detta förhindrar bindning, möjliggör aktivering av signalmolekylsubstrat såsom värmechock -transkriptionsfaktorn Hsf1. Kredit:Dr Sarah Perretts grupp
Värmechockprotein 70 (Hsp70)-proteiner är en familj av gamla och bevarade molekylära chaperoner. De spelar en viktig roll för att upprätthålla proteinhomeostas, inklusive att underlätta proteinvikning och nedbrytning, förhindra proteinaggregation, och delta i stressreaktionen. Avbrott i cellulära kvalitetskontrollmaskiner är förknippat med åldrande, cancer och neurodegenerativa sjukdomar.
Posttranslationella modifierings roll (PTM) vid regleringen av Hsp70:s funktioner är ett framväxande forskningsområde. Även om oxidativ stress kan vara skadligt, redoxvariation är ett naturligt inslag i den cellulära miljön och underlättar signalöverföring för viktiga fysiologiska aktiviteter. Cysteinmodifieringar av proteiner tillhandahåller huvudmedlen för redoxsignalöverföring. Glutationionering är en reversibel modifiering av cysteinrester i proteiner, som kan skydda proteiner från irreversibel oxidation, och kan också spela en roll vid signaltransduktion.
I den här studien, glutationylering av olika Hsp70 -familjemedlemmar detekterades i HeLa -celler och modifieringsställena fastställdes med masspektrometri av forskare från prof. Sarah Perrett och prof. Chen Changs grupp vid Institute of Biophysics of the Chinese Academy of Sciences.
Fokus på stressinducerbar Hsp70 HspA1A (hHsp70), den detaljerade strukturella mekanismen för hur glutationylering påverkar proteinaktivitet och protein-proteininteraktioner undersöktes.
In vivo-detektion visade att var och en av de fem cysteinresterna av hHsp70 kan genomgå glutationylering. In vitro-experiment visade att modifiering av cystein i nukleotidbindande domän för hHsp70 förhindras genom nukleotidbindning, men att Cys-574 och Cys-603, beläget i det C-terminala α-spiralformade locket av substratbindande domän, kan genomgå glutationylering i både närvaro och frånvaro av nukleotid.
Genom att lösa NMR-strukturen för den glutationylerade formen av hHsp70 SBD, den strukturella grunden för de funktionella förändringarna demonstrerades. Glutationionylering av dessa cysteinrester resulterar i att den a-spiralformade lockstrukturen utvecklas. Den ovikta regionen härmar substrat genom att binda till och blockera substratbindningsstället, därigenom främja inneboende ATPas -aktivitet, och konkurrerar med bindning av externa substrat. Detta leder till en minskning av dess förmåga att binda andra substratproteiner, såsom värmechockfaktorn Hsf1.
Dessa resultat indikerar inte bara att cysteinmodifiering kan förändra strukturen och funktionen av hHsp70, men också att hHsp70 kan överföra redoxinformation till sina klienter.
Denna studie publicerades i Journal of Biological Chemistry den 12 juni 2020.