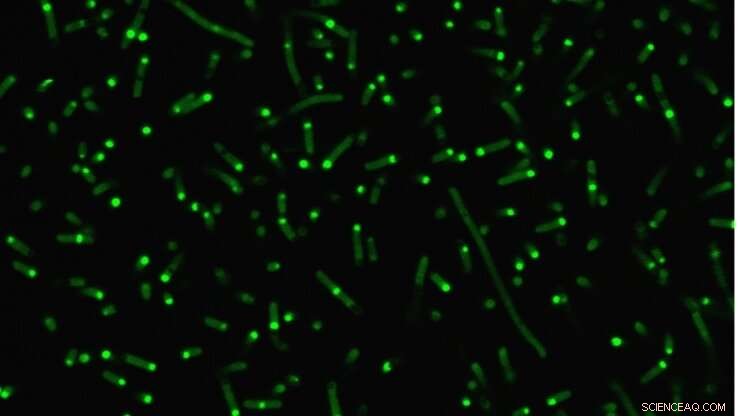
Inneboende störda proteiner (fluorescerande grönt) klumpar ihop sig i celler för att bilda konstgjorda organeller. Kredit:Duke University
Biomedicinska ingenjörer vid Duke University har demonstrerat en metod för att kontrollera fasseparationen av en framväxande klass av proteiner för att skapa artificiella membranlösa organeller i mänskliga celler. Förskottet, liknar att kontrollera hur vinäger bildar droppar i olja, skapar möjligheter för att konstruera syntetiska strukturer för att modulera befintliga cellfunktioner eller skapa helt nya beteenden inom celler.
Resultaten visas online den 3 augusti i tidskriften Naturkemi .
Proteiner fungerar genom att vikas till specifika 3D-former som interagerar med olika biomolekylära strukturer. Forskare trodde tidigare att proteiner behövde dessa fasta former för att fungera. Men under de senaste två decennierna, en stor ny klass av intrinsically disordered proteiner (IDP) har upptäckts som har stora regioner som är "floppy" - det vill säga, de viker sig inte till en definierad 3D-form. Det är nu underförstått att dessa regioner spelar en viktig, tidigare okänd roll i att kontrollera olika cellulära funktioner.
IDP:er är också användbara för biomedicinska applikationer eftersom de kan genomgå fasövergångar - från en vätska till en gel, till exempel, eller från ett lösligt till ett olösligt tillstånd, och tillbaka igen – som svar på miljöutlösare, som förändringar i temperatur. Dessa egenskaper dikterar också deras fasbeteende i cellulära miljöer och kontrolleras genom att justera egenskaperna hos IDP:erna såsom deras molekylvikt eller sekvensen i vilken aminosyrorna är sammanlänkade.
"Även om det finns många naturliga IDP:er som visar fasbeteende i celler, de finns i många olika smaker, och det har varit svårt att urskilja reglerna som styr detta beteende, " sa Ashutosh Chilkoti, Alan L. Kaganov framstående professor i biomedicinsk teknik vid Duke. "Detta dokument ger mycket enkla tekniska principer för att programmera detta beteende inom en cell."
"Andra i fältet har tagit en uppifrån-och-ned-strategi där de kommer att göra en förändring av en naturlig IDP och se hur dess beteende förändras inom en cell, sa Michael Dzuricky, en forskare som arbetar i Chilkoti-laboratoriet och första författare till studien. "Vi tar det motsatta tillvägagångssättet och bygger våra egna artificiella IDP:er från enkla termodynamiska principer. Detta gör det möjligt för oss och andra att justera en enskild egenskap - formen på IDP:s fasdiagram - för att bättre förstå hur denna parameter påverkar biologiskt beteende."
I den nya tidningen, forskarna börjar med att titta på naturen efter exempel på internflyktingar som går samman för att bilda "biomolekylära kondensat" i celler. Dessa svagt sammanhållna strukturer tillåter celler att skapa fack utan att också bygga ett membran för att kapsla in det. Att använda en sådan IDP från den vanliga fruktflugan som grund, forskarna hämtar från sin omfattande historia av att arbeta med internflyktingar för att konstruera en molekylärt enklare artificiell version som behåller samma beteende.
Denna enklare version gjorde det möjligt för forskarna att göra exakta ändringar av molekylvikten för IDP:erna och aminosyrorna i IDP:erna. Forskarna visar att beroende på hur dessa två variabler justeras, IDP:erna samlas för att bilda dessa fack vid olika temperaturer i ett provrör. Och genom att konsekvent prova olika justeringar och temperaturer, forskarna fick en gedigen förståelse för vilka designparametrar som är viktigast för att kontrollera IDP:s beteende.
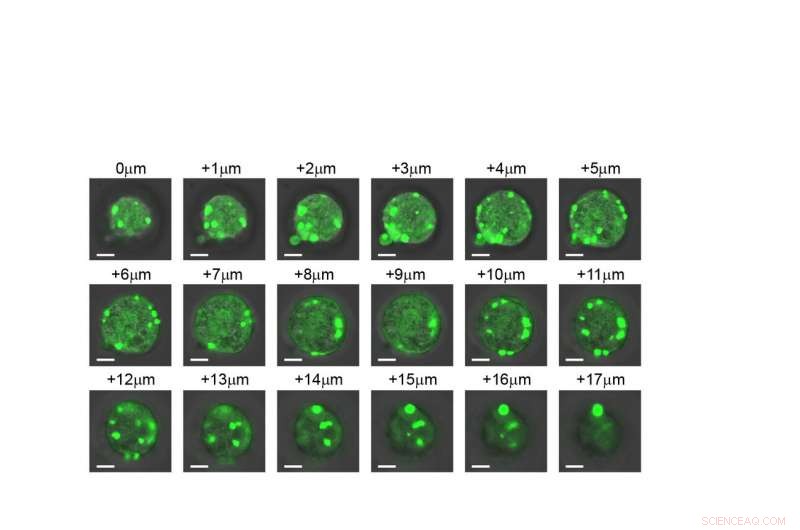
En skiva-för-skiva vy av en cell som visar att de konstgjorda organellerna bildas genom hela strukturen. Kredit:Duke University
Ett provrör, dock, är inte detsamma som en levande cell, så forskarna gick sedan ett steg längre för att visa hur deras konstruerade internflyktingar beter sig inom E. coli. Som förutspått, deras artificiella IDP:er grupperade tillsammans för att bilda en liten droppe i cellens cytoplasma. Och eftersom IDP:s beteende nu var så väl förstått, forskarna visade att de på ett förutsägbart sätt kunde kontrollera hur de smälte samman med hjälp av sina provrörsprinciper som vägledning.
"Vi kunde ändra temperaturer i celler för att utveckla en fullständig beskrivning av deras fasbeteende, som speglade våra provrörsförutsägelser, " sade Dzuricky. "Vid denna punkt, vi kunde designa olika artificiella IDP-system där dropparna som bildas har olika materialegenskaper."
Uttryckt på ett annat sätt, eftersom forskarna förstod hur man manipulerar storleken och sammansättningen av IDP:erna för att svara på temperatur, de kunde programmera IDP:erna för att bilda droppar eller fack med varierande täthet i celler. För att visa hur denna förmåga kan vara användbar för biomedicinska ingenjörer, forskarna använde sedan sin nyfunna kunskap, som naturen ofta gör, att skapa en organell som utför en specifik funktion inom en cell.
Forskarna visade att de kunde använda IDP:erna för att kapsla in ett enzym för att kontrollera dess aktivitetsnivå. Genom att variera molekylvikten för IDP:erna, IDP:erna håller på enzymet antingen ökat eller minskat, vilket i sin tur påverkade hur mycket det kunde interagera med resten av cellen.
För att visa denna förmåga, forskarna valde ett enzym som används av E. coli för att omvandla laktos till användbara sockerarter. Dock, I detta fall, forskarna spårade detta enzyms aktivitet med en fluorescerande reporter i realtid för att fastställa hur den konstruerade IDP-organellen påverkade enzymaktiviteten.
I framtiden, forskarna tror att de skulle kunna använda sina nya IDP-organeller för att kontrollera aktivitetsnivåerna för biomolekyler som är viktiga för sjukdomstillstånd. Eller för att lära sig hur naturliga IDP:er fyller liknande cellulära roller och förstår hur och varför de ibland inte fungerar.
"Detta är första gången någon har kunnat exakt definiera hur proteinsekvensen styr fasseparationsbeteendet inuti celler, " sa Dzuricky. "Vi använde ett konstgjort system, men vi tror att samma regler gäller för naturliga internflyktingar och är glada över att börja testa denna teori."
"Vi kan nu också börja programmera den här typen av fasbeteende med vilket protein som helst i en cell genom att smälta dem till dessa artificiella IDP:er, ", sade Chilkoti. "Vi hoppas att dessa artificiella internflyktingar kommer att ge ett nytt verktyg för syntetisk biologi för att kontrollera cellbeteende."