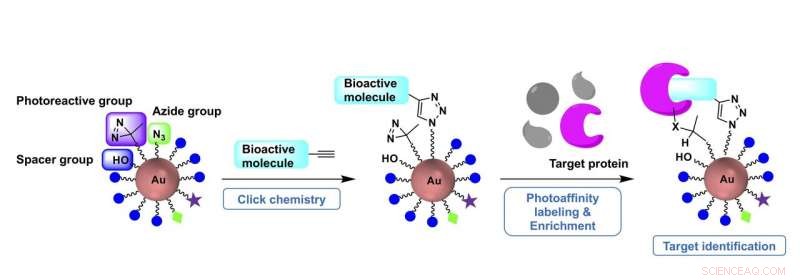
Enstegsberedning av fotoaffinitetssonder med klickbara guld-nanopartikelprekursorer möjliggör ändamålsenliga målidentifieringsstudier. Kredit:Figur modifierad från Organic and Biomolecular Chemistry, januari 2021, DOI:10.1039/D0OB01688H
Utvecklingen av farmaceutiska behandlingar är svår – läkare och forskare vet att ett visst läkemedel kan reglera särskilda funktioner, men de kanske inte vet hur det faktiskt fungerar. Forskare vid Tokyo University of Agriculture and Technology (TUAT) har utvecklat en ny, strömlinjeformad metod för att bättre förstå de molekylära mekanismerna som ligger till grund för dessa interaktioner.
De publicerade sitt tillvägagångssätt den 17 december, 2020 in Organisk och biomolekylär kemi, en tidskrift från U.K. Royal Society of Chemistry.
"Vi bestämde oss för att utveckla en ny guld-nanopartikelbaserad metod för målidentifiering av bioaktiva små molekyler som effektiviserar de nuvarande mödosamma stegen så att vi snabbt kan ta reda på hur dessa molekyler fungerar, sa Kaori Sakurai, docent vid institutionen för bioteknik och livsvetenskap vid TUAT.
Bioaktiva små molekyler är kemiska föreningar, såsom läkemedel, som lätt kan levereras till och interagera med kroppens celler. Genom att binda till specifika proteiner, dessa molekyler kan koppla om en biologisk process för att stoppa eller förbättra vad den ursprungliga funktionen var. Till exempel, de bioaktiva små molekylerna i ett anticancermedel kommer att binda med ett protein i cancerceller för att hämma deras okontrollerade tillväxt. De kan till och med lura cancercellerna till programmerad celldöd.
Utmaningen är att det inte alltid är klart vilka proteiner som riktas mot eller om det finns andra proteiner inriktade på som potentiellt kan orsaka oönskade biverkningar. Med hjälp av en teknik som kallas fotoaffinitetsmärkning, forskare kan belysa målproteiner och omedelbart tagga dem, fånga och identifiera dem. Dock, fotoaffinitetsmärkning kräver lång tid och resurser för att utveckla den specifika taggen, se till att det är fäst vid rätt mål i cellen och rena sedan det taggade målproteinet.
"Fotoaffinitetsmärkning är ett kraftfullt tillvägagångssätt för upptäckten av små molekylmålproteiner, "Sakurai. "Men, dess rutinmässiga användning har hindrats av flera problem, inklusive ineffektiv proteinmärkning och efterföljande rening och tekniska svårigheter att göra bioaktiva små molekyler till lämpliga prober."
Sakurais team tillhandahöll tidigare en lösning på det första problemet genom att använda en guldnanopartikel som modulära ställningar som en specifik sond kan designas på. I den senaste tidningen, de fokuserade på att utveckla en förberedelseprocess i ett steg.
Eftersom guldnanopartiklar har ytor som kan hålla modulära bitar, forskarna kan effektivt bygga skräddarsydda sammanställningar genom att helt enkelt blanda byggstenar, enligt pappersmedförfattaren Kanna Mori, en doktorand vid institutionen för bioteknik och livsvetenskap vid TUAT.
"Fotoaffinitetssonder kan lätt erhållas från sondprekursorerna, förmonterade med tre typer av byggstenar – var och en innehåller en klickbar grupp, en fotoreaktiv grupp och en vattenlöslig spacergrupp - och sedan snabbt införliva en liten molekyl av intresse genom "klickkemi, "" sa Mori.
Den tillverkade lilla molekylen, även efter att ha konjugerats till nanopartikeln, beter sig som en modermolekyl som naturligt skulle binda till ett protein, och den fotoreaktiva gruppen reagerar på ultraviolett ljus bestrålning som aktiverar sonden. När den väl har aktiverats, sonden kan fånga och isolera ett målprotein.
"Vi visade att klickbara fotoaffinitetsprobprekursorer kommer att ge snabb tillgång till fotoaffinitetssonder för olika typer av bioaktiva små molekyler för att identifiera deras målproteiner, sa Sakurai.
Nästa, forskarna planerar att utforska användbarheten av guld-nanopartikelsonder i målidentifieringsstudier i levande celler, utöka sitt arbete för att ta hänsyn till fysiologiska tillstånd. De planerar också att introducera komplexa naturprodukter och vissa läkemedel i guld-nanopartiklarna för att börja identifiera deras okända målproteiner.