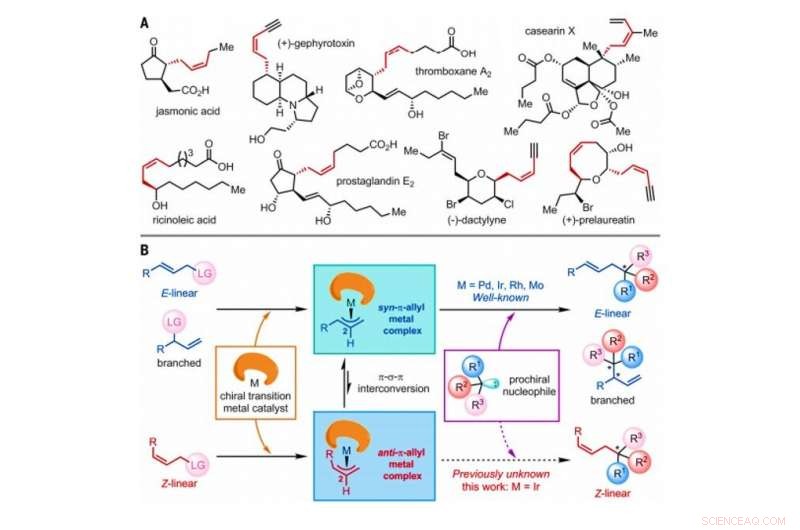
Strategi för konstruktion av Z-olefiner via asymmetriska allylsubstitutionsreaktioner katalyserade av övergångsmetallkatalysatorer. (A) Utvalda naturliga produkter som innehåller Z-olefiner med homoallyliska stereocenter. Mig, metyl. (B) Föreslagen allmän mekanism för övergångsmetallkatalyserade asymmetriska allylsubstitutionsreaktioner som involverar E-linjär, grenad, eller Z-linjära olefinsubstrat, som alla inkluderar en atom eller grupp av atomer betecknad som en lämnande grupp (LG). Kredit:Vetenskap, doi:10.1126/science.abd6095
Inom syntetisk organisk kemi, Z-olefiner är ett utmanande syntetiskt mål att producera i labbet på grund av deras relativa termodynamiska instabilitet. Z-olefinerna bildar en omättad förening med en C n H 2n formel som lätt kan isomeriseras. Analoga reaktioner som används för att syntetisera optiskt aktiva Z-olefinprodukter är sällsynta. I en ny rapport som nu publiceras den Vetenskap , Ru Jiang och ett forskarteam vid University of Chinese Academy of Sciences i Shanghai, Kina, detaljerade en iridiumkatalyserad asymmetrisk allylsubstitutionsreaktion för att bibehålla Z-olefingeometrier samtidigt som ett intilliggande kvartärt stereocentrum etablerades. Teamet observerade bildandet av övergående anti-π-allyl-iridium-intermediärer och deras infångning av externa nukleofiler (elektrondonator) före isomerisering för att bilda termodynamiskt mer stabila syn-π-allyl-iridium-motsvarigheter. Resultaten ger en lovande metod för att framställa kirala Z-olefinföreningar i labbet.
Olefiner
Den geometriska isomeren av Z-typ av olefiner observeras allmänt som grundläggande strukturer i naturen. Ändå, Z-olefiner är jämförelsevis mindre stabila jämfört med deras motsvarigheter av E-typ, och därför, det är svårt att selektivt syntetisera dem i organisk kemi. Vanliga metoder för att komma åt Z-olefiner inkluderar fotoinducerad isomerisering av E-olefiner, Witting olefinering, Z-selektiv korsmetates, Z-retentiv korskoppling och asymmetrisk addition av Z-allylboronnukleofiler till ketoner och iminer. Z-olefinerna med ett homoallyliskt stereocenter är ofta inbäddade i olika naturprodukter och bioaktiva molekyler för att generera ett stort intresse för syntetisk organisk kemi. Forskare har visat förmågan att utföra asymmetriska allylsubstitutionsreaktioner katalyserade av övergångsmetaller inklusive molybden (Mo), palladium (Pd), iridium (Ir) och rodium (Rh). Sedan den första rapporten 1997, Ir-katalyserade asymmetriska allyliska substitutionsreaktioner har fått intensiv uppmärksamhet på grund av deras exceptionellt höga regio- och enantioselektiva natur. I det här arbetet, Jiang et al. rapporterade reaktioner av Z-linjära allyliska substrat med tryptaminer och tryptofol. Under den omfattande analysen av reaktionsmekanismer, de noterade bildandet av viktiga anti-π-allyl-iridium-komplex, före isomerisering för att bilda de termodynamiskt stabila syn-π-allyl-iridiummotsvarigheterna.
Substratomfattning av Ir-katalyserade Z-retentionsreaktioner med asymmetriska allylsubstitutioner av indolderivat. Alla reaktioner utfördes enligt de villkor som anges här, om inte annat anges. Det geometriska förhållandet av Z-typ till E-typ (Z/E) och det diastereomera förhållandet (dr) bestämdes genom IH NMR-analys av de råa blandningarna. De isolerade utbytena av Z-3 rapporteras. ee-värdena bestämdes genom högpresterande vätskekromatografi (HPLC) analys med en kiral stationär fas. Asterisk indikerar ett Z/E-förhållande på 7:1. En dolksymbol indikerar ett Z/E-förhållande på 8:1. Dubbeldolksymbol indikerar att reaktionerna utfördes under 1 dag. Sektionssymbol indikerar ett Z/E-förhållande på 11:1. Styckesymbol indikerar att reaktionerna utfördes med användning av (Z)-non-2-en-1-ylacetat, [Ir(COD)Cl]2 (3 mol %), (S)-L1 (6 mol %), InBr3 (1,0 ekv.), och tetrabutylammoniumbromid (0,5 ekv.) i CHCI3 vid 0°C. Pundsymbol indikerar att reaktionerna utfördes med användning av motsvarande Z-allylacetat, [Ir(COD)Cl]2 (4,5 mol-%), (S)-L2 (9 mol %), In(OTf)3 (0,5 ekv. för Z-3aS och Z-3aT; 1 ekv. för Z-3aU) i CHCl3 vid -10°C i 2 dagar. Bn, bensyl; Bu, butyl; Et, etyl; Fröken, mesyl; Ph, fenyl; PMB, para-metoxibensyl; p-Tol, para-tolyl; Ts, tosyl. Kredit:Vetenskap, doi:10.1126/science.abd6095 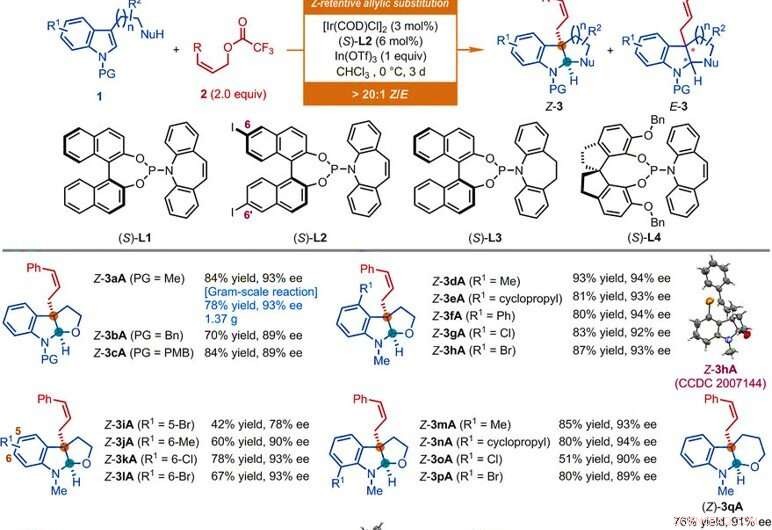
Forskarna undersökte först den asymmetriska allyliska avaromatiseringsreaktionen som involverade nukleofiler som N-metyltryptofol med Z-cinnamylderivat. Genom att använda Z-cinnamylacetat, de uppnådde den önskade reaktionen med en katalysator härledd från iridiumcyklooktadien (COD) klordimer i närvaro av andra syntetiska föreningar. Forskarna erhöll målprodukten med måttligt utbyte och enantioselektivitet med ett geometriskt förhållande av Z-typ till E-typ på 2:1. De optimerade sedan beståndsdelarna för att förbättra kvaliteten och utbytet av de syntetiska produkterna. Baserat på den föreslagna Z-retentiva asymmetriska allylsubstitutionsreaktionen, Jiang et al. erhållit olika funktionell gruppkompatibilitet som tolererade ett brett substratomfång. Teamet syntetiserade framgångsrikt mer än 50 exempel på (homo)tryptofoler, tryptaminer och indolsubstrat som bär en vidhängande kolbaserad nukleofil med användning av Z-cinnamylderivat. Nästan alla reaktioner gav ett utbyte av förhållanden av Z-typ till E-typ större än 20:1. Exempel inkluderar motsvarande Z-cinnamylerade furoindoliner (förkortade Z-3aA till Z-3pA), tetrahydropyranindolin (förkortat Z-3qA), pyrroloindoliner (förkortade Z-3a'A till Z-3o'A) och hexahydrocyklopentaindoler (förkortade Z-3a′′A till Z-3c′′A) med goda skördar på upp till 94 procent. Rent generellt, ersättningen av olika elektroniska och steriska egenskaper vid tillgängliga positioner av indolringen hade ingen skadlig inverkan på effektiviteten eller enantioselektiviteten hos reaktionen. Forskarna fastställde strukturerna och den absoluta konfigurationen av produkterna med hjälp av röntgenkristallografisk analys. De undersökte sedan också prestandan för D- och L-tryptofanderivaten.
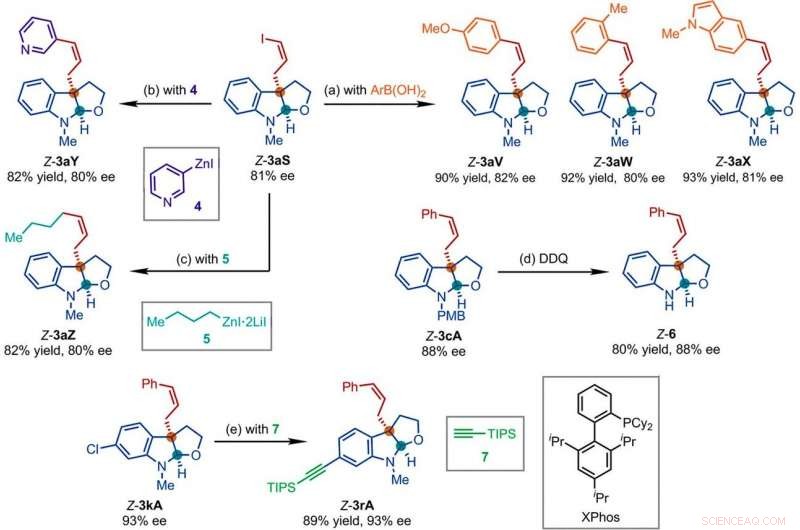
Representativa produkter erhållna i efterföljande reaktioner med produkterna från Ir-katalyserad Z-retentionsreaktion med asymmetrisk allylsubstitution. Reaktionsförhållanden:(a) Pd(PPh3)4 (0,5 mol-%), Cs2CO3 (2 ekv.), ArB(OH)2 (1,5 ekv.), acetonitril, 50°C; (b) 4 (2 ekv.), THF/diglyme (1:1), 110°C, 24 timmar; (c) 5 (2 ekv.), LiCl (4 ekv.), toluen/THF/TMU, 110°C, 24 timmar; (d) DDQ (1,5 ekv.), CH2Cl2, NaH2P04 (vattenhaltig 1 M); (e) 7 (2 ekv.), PdCl2(CH3CN)2 (5 mol-%), XPhos (15 mol %), Cs2CO3 (2,5 ekv.), acetonitril, 80°C. Ar, aryl; THF, tetrahydrofuran; TIPS, triisopropylsilyl; TMU, 1, 1, 3, 3-tetrametylurea. Kredit:Vetenskap, doi:10.1126/science.abd6095
Nedströms transformationer
Forskarna studerade sedan hur ett antal produkter från den Z-retentions asymmetriska allylsubstitutionsreaktionen lätt kunde undersökas i olika nedströmstransformationer. Till exempel, Z-vinyljodiden av kirala furoindoliner (förkortat Z-3aS) var reaktiv mot arylboronsyror och organozinkreagenser. Detta gav en alternativ väg att producera representativa produkter med Ir-katalyserad, Z-retentive asymmetric allylic substitution reactions with high yields of up to 82 to 93%. The scientists evaluated the proposed Z-retentive asymmetric allylic substitution reactions by a series of analyses. They obtained the Z-cinnamylated furoindolines (Z-3aA) product with optimal results in the presence of iridium atoms in the catalyst in a molar ratio of 1:1. They then characterized the key intermediates in the catalytic cycle and elucidated their structures using nuclear magnetic resonance (NMR) spectroscopy alongside X-ray crystallographic analysis. The team also monitored the reactions using electrospray ionization mass spectrometry and mechanistic studies. These results showed the isomerization of the complex from an anti- to the syn-π-allyl-iridium complex. Kollektivt, the analyses showed how the proposed Z-retentive asymmetric allylic substitution reaction successfully originated from the rapid and enantioselective capture of the transient anti-π-allyl-iridium complex by external nucleophiles, before converting it to more thermodynamically stable species.
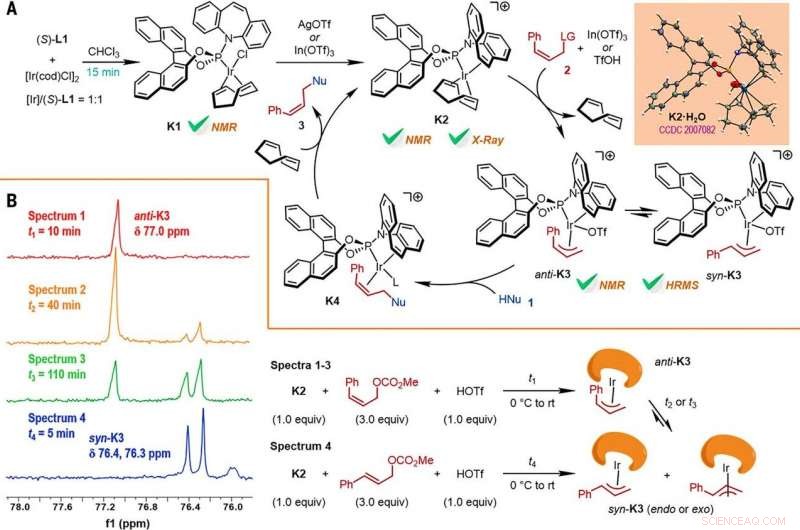
Reaction mechanism studies. (A) A proposed catalytic cycle. The key intermediates K1 and K2 were characterized by NMR spectroscopy, while K2•H2O was characterized by x-ray crystallographic analysis. HRMS, high-resolution mass spectrometry. (B) The reactions of K2 with Z- or E-cinnamyl methyl carbonate demonstrated isomerization from anti-K3 to syn-K3 according to the results of monitoring by electrospray ionization mass spectrometry (ESI-MS) and 31P NMR spectroscopy, the results of which are shown at left, with the details given by the reaction process diagrams to the right. Credit:Science, doi:10.1126/science.abd6095
Exploring the synthetic spectrum
The scientists also explored the extension of this iridium-catalyzed Z-retentive asymmetric allylic substitution reaction to other nucleophiles. Aside from the iridium catalysts containing Carreira-type chiral ligands that function under acidic conditions, they explored Ir catalysts derived from a Feringa-type chiral phosphoramidite ligand applied under basic conditions for this reaction mode. Som ett resultat, Jiang et al. used diverse nucleophiles beyond tryptophols and tryptamines. I det här fallet, they formed the prochiral nucleophiles from a copper (Cu) source. The independently prepared chiral cyclometallated Ir complex promoted the development of the transient anti-π-allyl-iridium complexes as well as their regio- and enantio-selective captures. The broad scope of the reaction presented more than 30 synthetic samples in good yields with excellent enantioselectivity. The scientists investigated the structure and absolute configuration of the products using X-ray crystallographic analyses. When the team used Z-cinnamyl acetate, they obtained a mixture of the desired Z-cinnamylated product and its branched isomer. The results highlighted the possibility of using the proposed protocol to accommodate diverse prochiral nucleophiles in asymmetric allylic substitution reactions. The researchers expect the work to evolve into a broadly practical method to synthesize chiral Z-olefins in the lab.
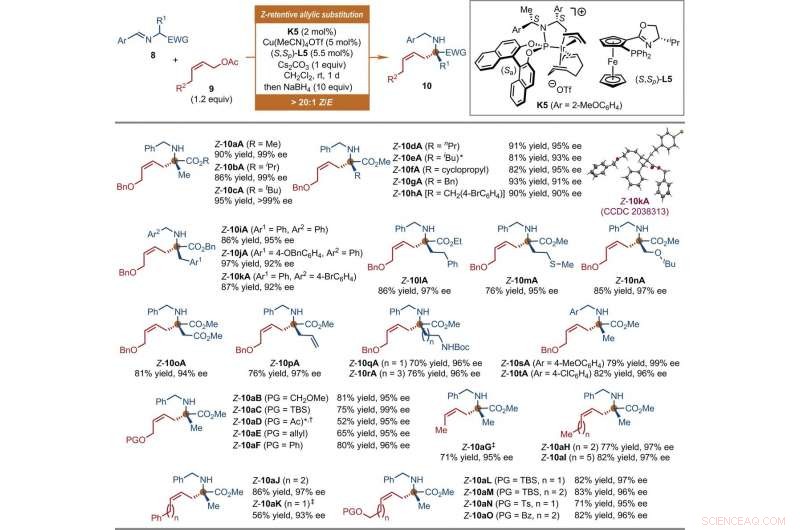
Substrate scope of Ir-catalyzed Z-retentive asymmetric allylic substitution reactions of a-amino acid derivatives. All reactions were conducted under the following conditions. Step 1:8 (0.2 mmol, 1 equiv), 9 (1.2 equiv), K5 (2 mol %), Cu(MeCN)4OTf (5 mol %), (S, Sp)-L5 (5.5 mol %), and Cs2CO3 (1 equiv) in CH2Cl2 (2 ml) at room temperature. Step 2:Reaction residue of step 1, NaBH4 (10 equiv) in CH2Cl2/MeOH (1:1, 4 ml) at room temperature. The Z-type to E-type geometric ratio (Z/E) values were determined by 1 H NMR analysis of the crude mixtures of step 1. The isolated yields of linear Z-10 are reported. The ee values were determined by HPLC analysis with a chiral stationary phase. The asterisk indicates that 9 (1.5 equiv) and K5 (4 mol %) were used. The single-dagger symbol indicates a Z/E ratio of 5.3:1. The double-dagger symbol indicates that 9 (2 equiv) was used. Ac, acetyl; Boc, tert-butoxycarbonyl; Bz, benzoyl; EWG, electron-withdrawing group; PG, protecting group; Pr, propyl; TBS, tert-butyldimethylsilyl. Credit:Science, doi:10.1126/science.abd6095
© 2021 Science X Network