Kredit:CC0 Public Domain
Peptider, som är korta strängar av aminosyror, spelar en viktig roll inom hälsa och industri med ett stort antal medicinska användningsområden, inklusive antibiotika, antiinflammatoriska och anticancerläkemedel. De används också inom kosmetikaindustrin och för att förbättra atletisk prestation. Att ändra strukturen hos naturliga peptider för att producera förbättrade föreningar är därför av stort intresse för forskare och industri. Men hur maskineriet som producerar dessa peptider fungerar är fortfarande inte klart förstått.
Docent Max Cryle från Monash Universitys Biomedicine Discovery Institute (BDI) har avslöjat en nyckelaspekt av peptidmaskineri i en artikel publicerad i Naturkommunikation idag som ger en nyckel till den heliga gralen av omarbetade peptider.
Resultaten kommer att främja hans labbs arbete med att omkonstruera glykopeptidantibiotika för att motverka det pressande globala hotet från antimikrobiell resistens, och mer allmänt till att förbättra egenskaperna hos peptider generellt.
"Peptidsyntesmaskiner är ofta till stor del modulära monteringslinjer, där varje modul består av olika komponentdelar. Ändra vad du gör i dessa monteringslinjer, det är, peptider med nya bioaktiviteter, är en "helig gral" i redesign, ", sa docent Cryle. "En av de saker vi försökte förstå i den här studien var var selektiviteten hos dessa maskiner kommer ifrån - de är väldigt selektiva för att göra en specifik peptid och att förstå var denna specificitet kommer ifrån är lite av en mysterium, " han sa.
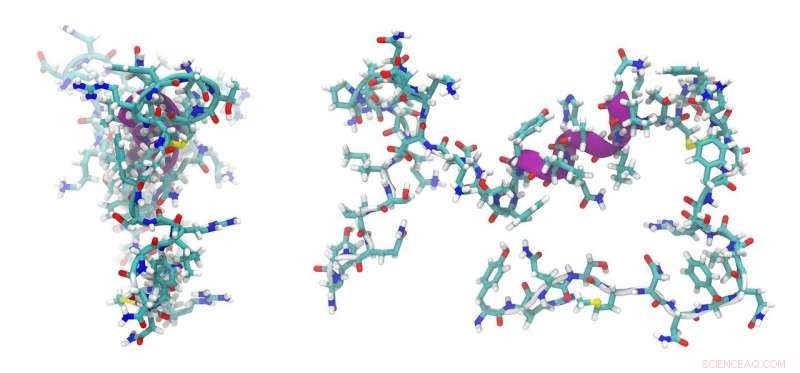
"Vi kunde strukturellt karakterisera en del av ett sådant maskineri som genererar länkarna i peptiderna i ett stadium som inte har fastställts tidigare. Det vi visade är att dessa domäner som är ansvariga för länkningen av aminosyror till peptider inte gör det. spelar en allmän roll i valet av aminosyrorna under denna process."
"Detta är goda nyheter ur en omkonstruktionssynpunkt eftersom det betyder att vi inte behöver bry oss om att ändra flera delar av maskineriet för att göra enstaka aminosyraförändringar, vi behöver bara fokusera på att ändra byggstenen som går in och det är ganska lovande."
Docent Cryle ledde ett tvärvetenskapligt team av forskare som anlitade en mängd olika tekniker för att modellera peptidstrukturerna, inklusive att använda den australiska synkrotronen för röntgenkristallografi tillsammans med kemiska och biokemiska tekniker. Han samarbetade med grupper i Canberra, Brisbane och Tyskland som hjälpte till med beräkningsmodellering och bioinformatik.
"Vår förmåga att förstå enzymerna som gör naturliga peptider är nyckeln till vår förmåga att producera förbättrade för att rikta in sig på problem som antimikrobiell resistens, ", sa han. "Nu kan vi faktiskt börja fundera på sätt att förändra maskineriets acceptans av olika byggstenar och på så sätt kan vi göra nya peptider med förbättrade antibakteriella egenskaper, " han sa.
I framtiden, ett samarbete med Dr. Evi Stegmanns grupp vid universitetet i Tübingen i Tyskland kommer att hjälpa till att översätta resultaten från en teoretisk labblösning till att så småningom utveckla en kommersiell produktion av nya och förbättrade antibiotika, han sa.