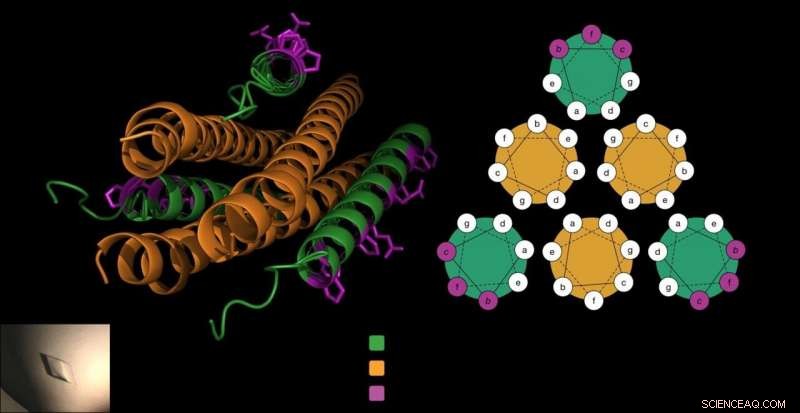
Den antivirala peptiden består av tre korkskruvar (i grönt), som låser sig runt virusets fusionsprotein (i orange) för att förhindra att viruset kommer in i cellerna. Gellman-labbet tillsatte unika beta-aminosyror till peptiden (i lila) på ett sätt som inte störde denna avgörande interaktion och gjorde peptiden mer stabil. Kredit:Victor Outlaw.
Genom att konstruera en kort bit protein, eller peptid, som kan förhindra fastsättning av humana parainfluensavirus till celler, forskare har förbättrat en metod i gnagarmodeller som syftar till att hålla barn friska.
mänskliga parainfluensavirus, eller HPIV, är den främsta orsaken till luftvägsinfektioner hos barn, ansvarig för 30 % till 40 % av sjukdomar som krupp och lunginflammation. Virusen drabbar även äldre och personer med nedsatt immunförsvar.
Att sjuka människor, HPIV måste haka fast i celler och injicera deras genetiska material för att börja skapa nya virus. HPIV3 är det vanligaste bland dessa virus. Det finns för närvarande inga godkända vacciner eller antivirala medel för HPIV3-infektion hos människor.
I en studie ledd av Sam Gellman-labbet vid kemiavdelningen vid University of Wisconsin-Madison, och Anne Mosconas och Matteo Porottos labb vid Columbia University, forskare byggde på år av arbete med peptidbehandlingar för att generera en som kan blockera HPIV3-bindningsprocessen.
Forskarna publicerade sina resultat den 7 april i Journal of the American Chemical Society .
För att komma in i värdceller, HPIVs använder specialiserade fusionsproteiner som liknar tre korkskruvar som läggs sida vid sida. Tidigare arbete av Moscona-Porotto-labbet visade att forskare kunde en del av detta korkskruvsprotein från HPIV3, introducera denna peptid till viruset, och förhindra att korkskruven driver infektionsprocessen. Peptiden, själv en korkskruv, dragkedja upp med virusets korkskruvar, skapa en tät bunt av sex korkskruvsformer.
Den nya peptiden finns kvar längre i kroppen, vilket gör det ungefär tre gånger effektivare för att blockera infektion i gnagarmodeller av sjukdomar än den ursprungliga formen.
Forskargruppen började med att försöka konstruera den ursprungliga peptiden för att vara mer resistent mot proteinsmältande enzymer i kroppen, som lätt kan strimla proteiner och göra dem oanvändbara. Så, Gellman-labbet använde ovanliga byggstenar för att skapa en hårdare peptid.
Celler bygger proteiner av alfa-aminosyror. Men kemister kan skapa betaaminosyror, som liknar varandra men har en extra kolatom. När peptider använder dessa beta-aminosyrabyggstenar, de tar ofta en annan form på grund av den extra atomen. Detta kan hjälpa en peptid att gömma sig från proteinsmältande enzymer och överleva längre.
Dock, forskarna visste också att om peptidens form förändrades för mycket som ett resultat av dessa ovanliga byggstenar, de kanske inte låser ihop med HPIV:s korkskruvsfusionsprotein.
Det var där Gellman-labbets decennier av erfarenhet av att testa och modifiera betaaminosyrainnehållande peptider blev avgörande.
"Vi vet vilken sida av peptiden som binder till dess proteinmål. Så, vi (visste att vi) kan modifiera endast rester som inte är direkt involverade i att binda det virala proteinet, " säger Victor Outlaw, en postdoktor i labbet och en av de första författarna till rapporten. I labbtester, de såg att den noggrant modifierade peptiden fortfarande band starkt till virusets protein.
I en annan förbättring som banat väg från Moscona-Porotto-labbet, forskarna kopplade upp peptiden till en molekyl av kolesterol. Detta fetttillskott hjälper peptiden att glida in i det feta cellmembranet, där det bäst kan blockera viruset.
"Vår hypotes var att kombinationen av betaaminosyror och kolesterol skulle öka antiviral effekt, säger Outlaw, som förklarade att kolesterolet hjälpte till att få peptiden dit den behövde gå, medan formförändringen från beta-aminosyrorna gjorde att peptiden kunde kvarstå längre i kroppen.
Som forskargruppen hoppades, när de gav den nya peptiden till bomullsråttor höll den mycket längre i lungorna än den tidigare versionen gjorde tack vare dess motståndskraft mot matsmältning av enzymer. Peptiden levererades till råttornas nos.
För att testa hur väl peptiden fungerade för att förhindra infektion, bomullsråttor fick den nya peptiden innan de exponerades för HPIV3. Jämfört med djur som inte fått några antivirala peptider, de som fick den förbättrade peptiden hade 10 gånger färre virus i lungorna.
Och jämfört med peptiden som var mer mottaglig för enzymer, den hårdare peptiden minskade virusmängden med cirka tre gånger, vilket tyder på att den nya peptidens förmåga att undvika matsmältning i kroppen hjälper den att bättre blockera infektioner.
Även om tillvägagångssättet ännu inte har testats på människor och forskare måste ytterligare förfina och testa systemet, det ger en ny strategi för att eventuellt förebygga eller behandla dessa vanliga infektioner.
Forskningssamarbetet är nu ute efter att göra andra generationens peptider som håller ännu längre i kroppen. De vill också testa hur väl den modifierade peptiden kan blockera infektion av relaterade virus. Den ytterligare forskningen skulle kunna flytta peptidbehandlingen närmare kliniska prövningar.
"Det här var en mycket tur att sammanföra grupper som hade kompletterande behov och förmågor, " säger Gellman. "Det har verkligen varit en stor gemensam insats."