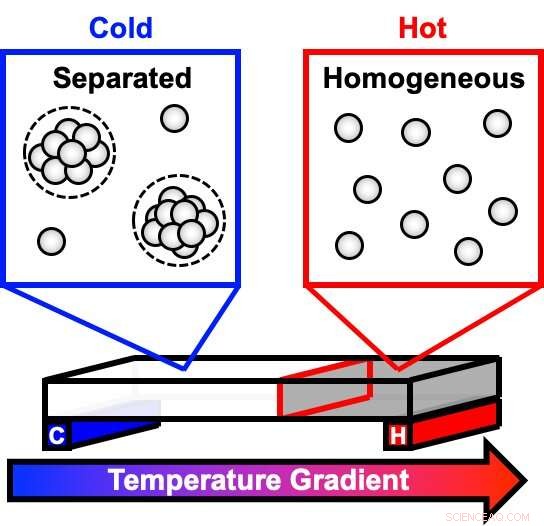
En ny studie använde en temperaturgradient för att observera hur högkoncentrerade antikroppslösningar, som de som är vanliga i vissa droger, separera i faser, som en olje- och vattenlösning. Vid kallare temperaturer, grumliga droppar börjar bildas i den en gång klara lösningen. När dropparna växer och sätter sig på botten av behållaren, lösningen separeras i två distinkta faser. Denna fasseparation kan påverka ett läkemedels hållbarhet och stabilitet. Kredit:Cremer Lab, Penn State
En ny matematisk modell beskriver hur högkoncentrerade antikroppslösningar separeras i olika faser, liknar en olja och vattenblandning. Denna separation kan minska stabiliteten och hållbarheten för vissa läkemedel som använder monoklonala antikroppar, inklusive några som används för att behandla autoimmuna sjukdomar och cancer. Ett team av forskare från Penn State och MedImmune, LLC (nu AstraZeneca) undersökte termodynamiken och kinetiken, sambandet mellan temperatur, energi, och graden av kemiska reaktioner, av fenomenet med en innovativ metod som möjliggör snabb studie av flera prover samtidigt. Ett papper som beskriver deras modell visas den 22 juli, 2019, i journalen Förfaranden från National Academy of Sciences .
Många läkemedel lagras idag som fasta ämnen och löses upp i IV -påsar för leverans till patienter, men läkemedelsindustrin har gått mot läkemedel som kan lagras som vätskor och ges via ett skott. Några av dessa läkemedelslösningar, som de som används för att behandla autoimmuna sjukdomar och vissa cancerformer, innehåller höga koncentrationer av monoklonala antikroppar - proteiner som fäster till främmande ämnen i kroppen, som bakterier och virus, flagga dem för förstörelse av patientens immunsystem.
"Högkoncentrerade proteinlösningar kan separeras i olika faser, som en vinaigrette salladsdressing som separeras i lager över tid, "sa Bradley Rogers, doktorand i kemi vid Penn State och första författare till tidningen. "Fasavskiljning är en av de vägar som gör dessa läkemedel instabila och olämpliga att använda. Den klassiska metoden för att förstå denna process innebär att man manipulerar temperaturen på ett prov över tid. Vi använde en temperaturgradient mikrofluidikplattform för att snabbt titta på många temperaturer samtidigt. "
En antikroppsrik lösning börjar som en klar vätska vid rumstemperatur, men när lösningen svalnar, grumliga droppar börjar bildas. Över tid, dropparna lägger sig till botten, med utspädd vätska kvar på toppen, så att provet verkar tydligt. Teamet använde en innovativ enhet som skapar ett intervall av temperaturer över en temperaturgradient och använde en teknik som kallas mörkfältavbildning för att mäta hur snabbt denna process sker. Sedan beräknade laget en mängd parametrar för att bättre förstå systemets termodynamik och kinetik, inklusive de temperaturer vid vilka fasövergångar inträffar och mängden energi som krävs för att gå från en fas till nästa - aktiveringsenergier.
"Vi observerade att den hastighet som en lösning separerar i två faser har ett märkligt beroende av temperatur, ", sade Rogers. "Detta förhållande är mycket mer komplicerat för koncentrerade antikroppslösningar än det är för andra system. Vi ägnade lång tid åt att försöka förstå data, men vi utvecklade så småningom en modell som förklarar vad vi ser."
Modellen beskriver hur antikroppsmolekyler håller ihop när temperaturen sjunker, bildar droppar som växer när ytterligare molekyler förenas. Denna reversibla process sker allt snabbare med sjunkande temperatur, eftersom lösningen blir allt mer mättad med fria antikroppsmolekyler. Sedan, när lösningen fortsätter att svalna, droppar fastnar på andra droppar och lägger sig till botten. Vid ännu kallare temperaturer, lösningen bildar en gel och kan inte slutföra separationen, även under en månad.
"I ett enda experiment, vi kan visualisera den homogena klara lösningen, den grumliga lösningen när droppar börjar bildas, den fasseparerade vätskan, och gelen, sade Paul Cremer, J. Lloyd Huck ordförande i naturvetenskap vid Penn State och senior författare till tidningen. "Tidigare forskning beskrev dessa olika tillstånd, och vår modell beskriver matematiken och den temperaturberoende kinetiken bakom det vi tror händer."
Nästa, forskargruppen planerar att undersöka om deras modell kan förklara fasseparation i andra system. De planerar också att testa om parametrar som samlats in från denna typ av experiment kan förutsäga stabilitet och hållbarhet hos läkemedel.
"Om dessa parametrar kan hjälpa oss att förutsäga stabilitet och hållbarhet, vi kanske kan välja ut bättre läkemedelskandidater, " said Rogers. "We may also be able to determine the ideal solution properties for a promising drug candidate to keep it stable."
In addition to Rogers and Cremer, the research team includes Kelvin Rembert, Matthew Poyton, Halil Okur, Amanda Kale, and Tinglu Yang at Penn State and Jifeng Zhang from AstraZeneca. The work was supported by MedImmune LLC (now AstraZeneca). Additional support was provided by the National Science Foundation.