Kredit:Oak Ridge National Laboratory
Medan alla virus har några medel för att bekämpa kroppens immunförsvar, Forskare har studerat hur SARS-CoV-2-coronaviruset – orsaken till den globala covid-19-pandemin – kan undvika immunsystemet hos människor.
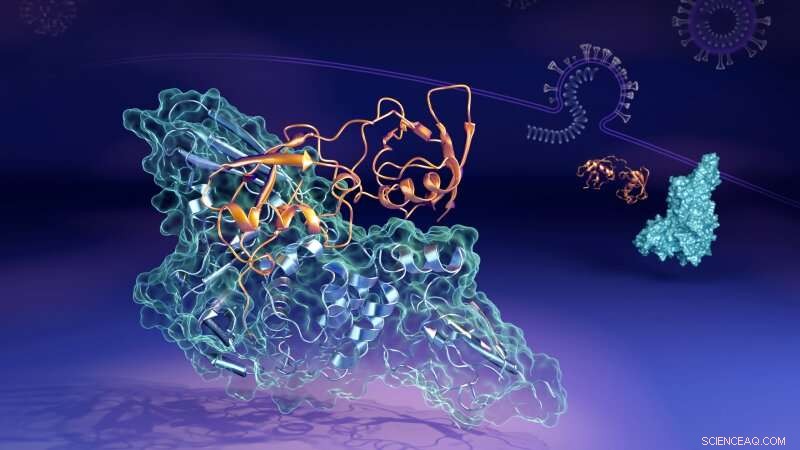
Nu har forskare som arbetar vid det amerikanska energidepartementets (DOEs) Oak Ridge National Laboratory (ORNL) avslöjat de molekylära detaljerna om hur ett nyckelprotein (det papainliknande proteaset, eller "PLpro") från viruset länkar upp till en parad struktur, eller "komplex, " med ett humant protein som heter interferonstimulerad gen 15 (ISG15). PLpro tar bort ISG15 från andra mänskliga cellulära proteiner för att hjälpa SARS-CoV-2 att undvika immunsvaret. Att förstå hur de två proteinerna interagerar kan hjälpa till att utveckla terapeutiska läkemedelsbehandlingar som förhindra dess bildande och tillåta en persons immunsystem att bättre bekämpa det invaderande viruset.
Forskningsresultaten, med titeln "Conformational Dynamics in the Interaction of SARS-CoV-2 Papain Like Protease with Human Interferon-Stimulated Gene 15 Protein, " publicerades i Journal of Physical Chemistry Letters .
"I mänskliga celler som viruset har infekterat, PLpro från SARS-CoV-2-viruset tenderar att söka upp och binda till ISG15-proteinet, en nyckelkomponent i cellernas immunsvar, sa Hugh O'Neill, ledare för ORNL:s Bio-Facilities-grupp och chef för labbets Center for Structural Molecular Biology. "När PLpro binder till ISG15, det får ISG15 att ändra form. Nyckelfyndet är att ISG15 kan anta flera former när det binder till PLpro. "
Genom att använda småvinklar neutronspridning (SANS) vid ORNL:s högflödesisotopreaktor (HFIR), forskarna kunde studera förändringarna i komplexet medan de inträffade.
"Vi förbättrade kontrasten mellan PLpro och ISG15 genom att förbereda PLpro där många av väteatomerna ersattes med deuteriumatomer, sa Kevin Weiss, en expert på biodeuteration. "Neutroner interagerar olika med deuteriumatomer, så detta hjälpte oss att bättre skilja mellan de två proteinerna.
"Vi använde neutroner för att analysera komplexet i lösning, som bättre simulerar den faktiska fysiologiska miljön i människokroppen, "sa Leighton Coates, instrumentsystemsvetenskaps- och teknikchef för ORNL:s andra målstation. "Detta gjorde det möjligt för oss att studera komplexets föränderliga former, som andra tekniker inte kunde ha tagit upp."
"Informationen vi fick från våra experiment ökar vår kunskap om hur viruset fungerar och kommer att göra det möjligt för oss att bygga mer exakta datormodeller som andra forskare kan använda, "sa Wellington Leite, huvudförfattare och ORNL postdoktor. "Forskare kommer att kunna använda modellen för att snabbt söka efter webbplatser på ISG15 där PLpro bifogar och sedan försöka blockera dessa webbplatser."
Susan Tsutakawa, en biokemistabforskare vid Lawrence Berkeley National Laboratory (Berkeley Lab), erhållit småvinklad röntgenspridningsdata (SAXS) om PLpro-ISG15-komplexet vid Berkeley Labs Advanced Light Source Synchrotron. "I SAXS-studierna, vi kunde separera olika komplex i provet genom att koppla SAXS med storleksexklusionskromatografi och samtidigt, få högre upplösningsdata för komplexets övergripande konfiguration, för att komplettera SANS-studierna som avslöjade konformationerna av enskilda komponenter i komplexet, sa Tsutakawa.
Teamet planerar att genomföra ytterligare experiment på denna typ av biologiskt komplex för att undersöka hur små molekyler kan blockera bindningen av PLpro till ISG15.