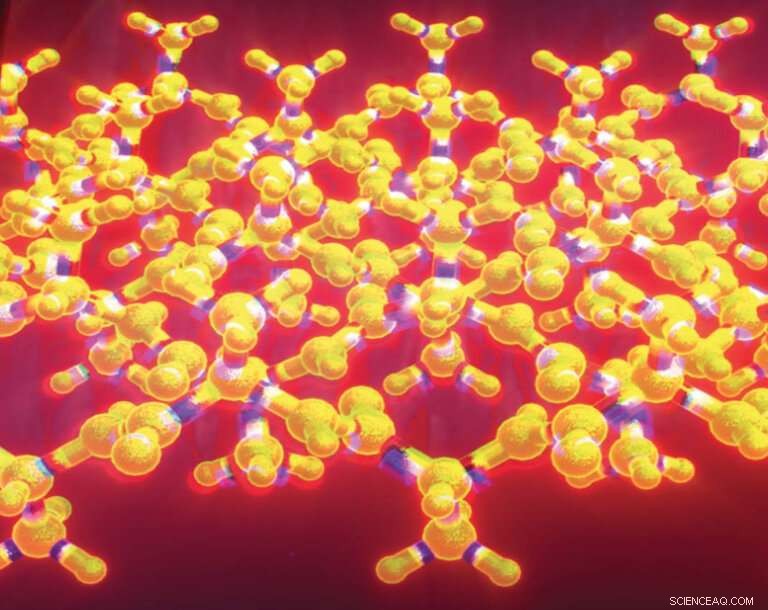
Det krusade betaarket är en variant på det veckade betaarket, ett välkänt strukturmotiv som finns i tusentals proteiner. Linus Pauling och Robert Corey beskrev det krusade betaarket 1953, men det förblev en till stor del teoretisk struktur i decennier. Forskare har nu skapat krusade ark i laboratoriet och karakteriserat strukturen med hjälp av röntgenkristallografi. Kredit:J. Raskatov
En ovanlig proteinstruktur känd som ett "rippled beta-ark", som först förutspåddes 1953, har nu skapats i laboratoriet och karakteriserats i detalj med hjälp av röntgenkristallografi.
De nya rönen, publicerade i juli i Chemical Science , kan möjliggöra en rationell design av unika material baserat på den böljande arkarkitekturen.
"Vår studie fastställer den böjda betaskiktskonfigurationen som ett motiv med allmänna egenskaper och öppnar vägen till strukturbaserad design av unika molekylära arkitekturer, med potential för materialutveckling och biomedicinska tillämpningar", säger Jevgenij Raskatov, docent i kemi och biokemi vid UC Santa Cruz och motsvarande författare till tidningen.
Proteiner finns i ett enormt utbud av former och storlekar för att utföra sina otaliga strukturella och funktionella roller i levande celler. Vissa vanliga strukturella motiv, som alfahelixen, finns i många proteinstrukturer.
Det krusade arket är en variant på det veckade betaarket, ett välkänt strukturmotiv som finns i tusentals proteiner. Linus Pauling och Robert Corey beskrev det krusade betaarket 1953, två år efter att de introducerade konceptet med det veckade betaarket. Medan det veckade betaarket är välkänt och ofta bara kallas för betaarket, förblev det krusade arket en till stor del teoretisk struktur i årtionden.
I en tidigare studie publicerad i Chemical Science 2021 rapporterade Raskatovs team att de fick en krusad beta-arkstruktur genom att blanda en liten peptid med lika stora mängder av dess spegelbild. Forskarna använde spegelbildsformer av trifenylalanin, en kort peptid som består av tre fenylalaninaminosyror. Spegelbildspeptiderna sammanfogades i par för att bilda "dimerer" med den förutspådda strukturen, men de bildade inte den utökade, periodiska krusade beta-arkskiktet som hypotesen av Pauling och Corey.
"Dimererna packades ihop i fiskbensskiktsstrukturer, vilket väckte tvivel om huruvida den periodiska ripplade beta-arkskiktskonfigurationen var genomförbar", sa Raskatov.
I den nya studien ersatte forskarna en av trifenylalaninerna med andra aminosyror för att skapa något annorlunda tripeptider och deras spegelbilder. Med hjälp av dessa nya tripeptider kunde de skapa tre olika aggregerande peptidsystem som bildade utökade antiparallella krusade beta-arklager, där spegelbildade peptidsträngar arrangerades på alternerande sätt. Resultaten av röntgenkristallografi visade att kristallstrukturerna är i utmärkt överensstämmelse med de förutsägelser som gjorts av Pauling och Corey. + Utforska vidare