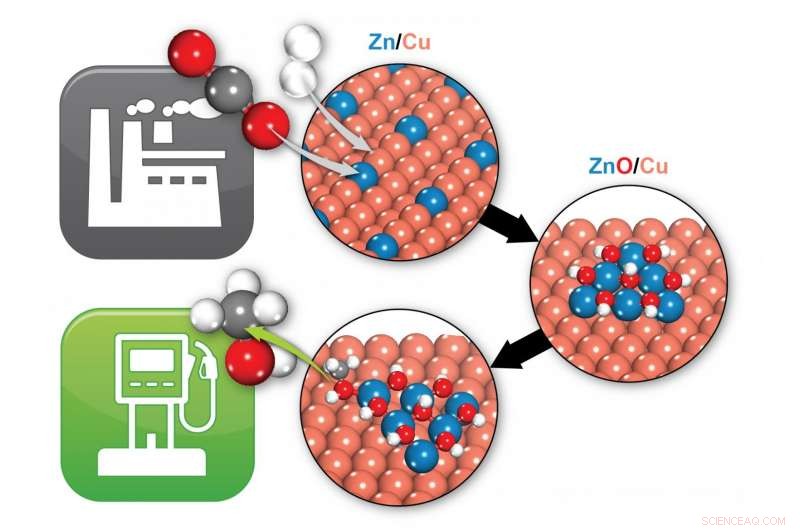
Brookhaven-forskare identifierade hur en zink/koppar (Zn/Cu) katalysator omvandlar koldioxid (två röda och en grå boll) och väte (två vita bollar) till metanol (en grå, en röd, och fyra vita bollar), ett potentiellt bränsle. Under reaktionsförhållanden, Zn/Cu omvandlas till ZnO/Cu, där gränssnittet mellan ZnO och Cu tillhandahåller de aktiva platserna som tillåter bildning av metanol. Kredit:Brookhaven National Laboratory
Att fånga koldioxid (CO2) och omvandla det till användbara kemikalier som metanol kan minska både föroreningar och vårt beroende av petroleumprodukter. Så forskare är intensivt intresserade av de katalysatorer som underlättar sådana kemiska omvandlingar. Liksom molekylära dealmakers, katalysatorer för samman de reagerande kemikalierna på ett sätt som gör det lättare för dem att bryta och omordna sina kemiska bindningar. Att förstå detaljer om dessa molekylära interaktioner kan peka på strategier för att förbättra katalysatorerna för mer energieffektiva reaktioner.
Med det målet i åtanke, kemister från det amerikanska energidepartementets Brookhaven National Laboratory och deras medarbetare släppte precis resultat från experiment och beräkningsmodelleringsstudier som definitivt identifierar den "aktiva platsen" för en katalysator som vanligtvis används för att göra metanol från CO2. Resultaten, publicerad i tidningen Vetenskap , lösa en långvarig debatt om exakt vilka katalytiska komponenter som deltar i de kemiska reaktionerna - och bör vara i fokus för ansträngningarna att öka prestandan.
"Denna katalysator tillverkad av koppar, zinkoxid, och aluminiumoxid-används i industrin, men det är inte särskilt effektivt eller selektivt, " sa Brookhaven kemisten Ping Liu, studiens huvudförfattare, som också har en adjungerad tjänst vid närliggande Stony Brook University (SBU). "Vi vill förbättra det, och få den att fungera vid lägre temperaturer och lägre tryck, som skulle spara energi, " Hon sa.
Men innan denna studie, olika grupper av forskare hade föreslagit två olika aktiva platser för katalysatorn - en del av systemet med bara koppar- och zinkatomer, eller en portion med kopparzinkoxid.
"Vi ville veta vilken del av molekylstrukturen som binder och bryter och skapar bindningar för att omvandla reaktanter till produkt - och hur det gör det, " sa medförfattaren Jose Rodriguez, en annan kemist i Brookhaven associerad med SBU.
Att få reda på, Rodriguez utförde en serie laboratorieexperiment med väldefinierade modellkatalysatorer, inklusive en gjord av zink-nanopartiklar uppburna på en kopparyta, och en annan med zinkoxidnanopartiklar på koppar. För att skilja de två åt, han använde en energisk röntgenstråle för att zappa proverna, och mätte egenskaperna hos emitterade elektroner. Dessa elektroniska "signaturer" innehåller information om oxidationstillståndet för atomerna elektronerna kom ifrån - oavsett om det är zink eller zinkoxid.
Under tiden Liu, Jingguang Chen från Brookhaven Lab och Columbia University, och Shyam Kattel, den första författaren av tidningen och en postdoktor som co-råd av Liu och Chen, använt beräkningsresurser vid Brookhavens Center for Functional Nanomaterials (CFN) och National Energy Research Scientific Computing Center (NERSC) - två DOE Office of Science User Facilities - för att modellera hur dessa två typer av katalysatorer skulle engagera sig i CO2-till-metanol-transformationerna . Dessa teoretiska studier använder beräkningar som tar hänsyn till de grundläggande principerna för att bryta och skapa kemiska bindningar, inklusive den energi som krävs, atomernas elektroniska tillstånd, och reaktionsbetingelserna, låta forskare härleda reaktionshastigheterna och avgöra vilken katalysator som ger den bästa omvandlingshastigheten.
"Vi fann att kopparzinkoxid borde ge de bästa resultaten, och att kopparzink inte ens är stabilt under reaktionsbetingelser, " sa Liu. "Faktiskt, det reagerar med syre och omvandlas till kopparzinkoxid."

Ping Liu och Shyam Kattel med röntgenkällan som används i denna studie. Kredit:Brookhaven National Laboratory
Dessa förutsägelser matchade vad Rodriguez observerade i laboratoriet. "Vi fann att alla platser som deltog i dessa reaktioner var kopparzinkoxid, " han sa.
Men glöm inte kopparn.
"I våra simuleringar, alla reaktionsmellanprodukter - kemikalierna som bildas på vägen från CO2 till metanol binder till både koppar- och zinkoxiden, ", sa Kattel. "Så det finns en synergi mellan koppar- och zinkoxiden som påskyndar den kemiska omvandlingen. Du behöver både koppar och zinkoxid. "
Att optimera koppar/zinkoxid-gränssnittet kommer att bli den drivande principen för att designa en ny katalysator, säger forskarna.
"Detta arbete visar tydligt synergin från att kombinera teoretiska och experimentella ansträngningar för att studera katalytiska system av industriell betydelse, "sade Chen." Vi kommer att fortsätta att använda samma kombinerade metoder i framtida studier. "
Till exempel, sa Rodriguez, "Vi kommer att prova olika konfigurationer av atomerna vid koppar/zinkoxidgränssnittet för att se hur det påverkar reaktionshastigheten. Dessutom, vi kommer att gå från att studera modellsystemet till system som skulle vara mer praktiska för industrin."

Jingguang Chen och Jose Rodriguez (stående) diskuterar den katalytiska mekanismen med Ping Liu och Shyam Kattel (sittande). Kredit:Brookhaven National Laboratory
Ett viktigt verktyg för detta nästa steg är Brookhaven's National Synchrotron Light Source II (NSLS-II), en annan Office of Science-användaranläggning. NSLS-II producerar extremt ljusa strålar av röntgenstrålar - cirka 10, 000 gånger ljusare än den bredstrålade laboratorieröntgenkällan som användes i denna studie. Dessa intensiva röntgenstrålar kommer att tillåta forskarna att ta högupplösta ögonblicksbilder som avslöjar både strukturell och kemisk information om katalysatorn, reaktanterna, och de kemiska mellanprodukterna som bildas när reaktionen sker.
"Och vi kommer att fortsätta att utöka teorin, ", sa Liu. "Teorin pekar på de mekanistiska detaljerna. Vi vill modifiera interaktioner vid koppar/zinkoxidgränssnittet för att se hur det påverkar aktiviteten och effektiviteten hos katalysatorn, och vi kommer att behöva teorin för att gå vidare med det också."