Grafiskt abstrakt. Kredit:Nature Chemistry (2022). DOI:10.1038/s41557-022-00937-w
Varje ögonblick i våra kroppars celler sker otaliga aktiviteter som är viktiga för livet tack vare enzymer. Dessa speciella proteiner fungerar som katalysatorer genom att accelerera takten och förbättra selektiviteten för kemiska reaktioner utan att själva genomgå permanenta förändringar. Utöver deras oumbärliga roll inom biologin är enzymer också avgörande för otaliga processer inom livsmedels-, läkemedels-, jordbruks- och kosmetikindustrin.
Enzymer är dåligt förstådda, eftersom de tror på deras förekomst och betydelse. Särskilt vill forskare veta vad som gör enzymernas aktiva platser - den fickliknande regionen där de snabba kemiska reaktionerna äger rum - så kraftfulla. Medan de tredimensionella atomstrukturerna för många enzymers aktiva platser har visualiserats och kartlagts, är den "osynliga" strukturen för de elektriska fälten inuti en aktiv plats mestadels okänd. Dessa elektriska fält anses spela en viktig roll för att bilda en exakt miljö på aktiva platser där molekyler reagerar och snabbt övergår till nya molekyler.
Nu har en studie ledd av Stanford-forskarna Chu Zheng och Yuezhi Mao debuterat en ny sond för att mäta och visualisera de elektriska fälten inuti ett enzyms aktiva plats. Uppsatsen, nyligen publicerad i tidskriften Nature Chemistry , rapporterar om orienteringen av elektriska fält vid reaktionsplatsen och kan hjälpa forskare att beräkna de viktigaste kemiska interaktionerna i aktiva platser. Dessa insikter skulle i sin tur kunna leda till att man bygger skräddarsydda syntetiska enzymer för industrin, samt att man avsevärt främjar upptäckten och designen av nya läkemedel som stör eller modulerar funktionen hos enzymmål.
"Vi har utvecklat en ny sond som kan ge oss viktig information om hur elektriska fält är unikt orienterade i enzymer, vilket vi tror är grundläggande för den fantastiska katalytiska kraften hos enzymer", säger Zheng, doktorand i Steven G. Boxer, Camille Dreyfus-professorn i kemi.
"På en grundläggande nivå försöker vi att bättre förstå hur enzymer fungerar, och i den här studien lägger vi till en ny dimension genom att ta in elektriska fältorienteringar som tros ha en kritisk inverkan på enzymets katalytiska funktioner," sa Mao. en postdoktor i kemi som arbetar i Thomas Marklands labb, en docent i kemi vid Stanford och även en senior medförfattare.
Ett kraftfullt nytt verktyg
Boxerlabbet i Stanford har banat väg för konceptet att tolka funktionaliteten hos enzymer genom att mäta elektrostatiska interaktioner, som finns i alla former av materia och är specifikt organiserade i tre dimensioner i stora biologiska molekyler.
"Ursprunget till den fantastiska funktionaliteten hos enzymer är en allmän fråga, och den gäller inte bara för biologisk katalys utan också kemisk katalys - vilket är en enorm verksamhet," sa Boxer. "Ungefär 80 procent av alla kemikalier tillverkas med katalysatorer, men vad som faktiskt är ansvarigt för att sänka den aktiveringsfria energin [för att få reaktionen att ske snabbare] är inte väl förstått för de flesta reaktioner. Att undersöka elektriska fälts roll i enzymfunktionen är mycket mycket i hjärtat av vårt arbete", säger Boxer, ordförande för Institutionen för kemi vid Stanfords School of Humanities and Sciences och en senior medförfattare till studien.
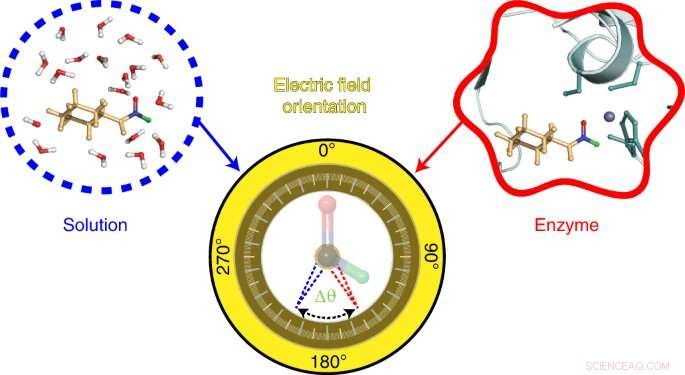
Sonden som utvecklats av Stanford-teamet bygger på en teknik – även utvecklad i Boxer-labbet – som kallas vibrationell Stark-effektspektroskopi. Denna teknik mäter vibrationsfrekvenserna i sondmolekyler baserat på våglängden hos infrarött ljus som absorberas av dess kemiska bindningar. Förskjutningar i dessa vibrationsfrekvenser avslöjar information om de elektriska fälten som finns. I den här studien undersökte forskarna förändringar i vibrationsfrekvenserna för kemiska bindningar i en sond gjord av en molekyl som kallas N-cyklohexylformamid. Denna molekyl fungerar som en inhibitor och binder till det aktiva stället för ett enzym som kallas leveralkoholdehydrogenas.
To visualize the electric field in the active site of liver alcohol dehydrogenase, the researchers targeted two bonds in the N-cyclohexylformamide probe about 120 degrees away from each other. That specific angle between the two bonds allowed the researchers to gauge not only the strength, or magnitude, of the electric field, but also the field's orientation. Previous studies from the Boxer lab on other enzyme active sites had reported on the magnitude of electric fields but not on their directions.
"We call this tool a two-directional probe because with this probe we can measure the electric field in an active site in two different directions," Zheng said. "Using the probe this way, we can reconstruct and extract the orientation information about the electric field. That hasn't been done in the past."
Gathering this key measurement first required some chemical sleight of hand. One of the N-cyclohexylformamide probe's chemical bonds—between a carbon atom and a hydrogen atom—is notoriously difficult to observe in protein environments. So, the researchers swapped the hydrogen atom for the element's heavier cousin, called deuterium. The new carbon–deuterium bond proved amenable to measurement, and helped the researchers reveal the orientation of the electric field.
A precise enzymatic environment
The Stanford researchers combined their experimental data with computer simulations and quantum mechanical calculations to describe the electric field's interactions with N-cyclohexylformamide, modified with deuterium, at the active site of liver alcohol dehydrogenase. Those properties were then compared to the electric fields found in water, acetone, and other common solvents.
Notably, the researchers found the orientation of the electric field in the active site of liver alcohol dehydrogenase differs considerably from the electric field orientation in the solvents they studied. That result supports the idea that enzyme active sites feature what scientists call a preorganized electrostatic environment, or one in which the precise positioning of amino acids and the electrostatic environment they create help reduce the energy required for a chemical reaction to take place. This could be a key to enzymes' remarkable ability to catalyze reactions.
"With this study, we are helping to advance the concept of correlating the performance of enzymes with both the magnitude and orientation of the electric fields in active sites," Mao said. "What we have found is evidence that electric fields in the enzyme active sites are preorganized, and that is an important clue in solving the mystery of why enzymes have their amazing abilities."
The probe developed by the Stanford researchers could be used to investigate many other enzymes' active sites. Broadening knowledge in this way will bring scientists and engineers closer to being able to design bespoke enzymes with spectacular new characteristics.
"The ultimate goal of this research is to enable us to design enzymes that have superb catalytic performance for biomedical and industrial application," Zheng said. "We are still far from that, but we are making progress and have a better understanding now than before regarding how enzymes work." + Utforska vidare