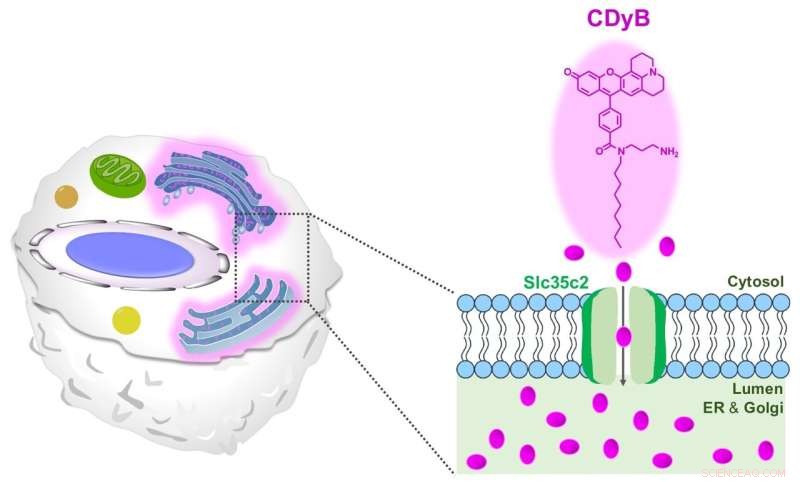
Den föreslagna färgningsmekanismen för CDyB. Kredit:Institutet för grundvetenskap
Vårt immunförsvar är avgörande för vår överlevnad, eftersom våra kroppar ständigt utsätts för bakterier, virus, parasiter och andra patogener. Utan ett immunsystem skulle vi snabbt förlora kriget mot dessa patogener och ge efter för dessa utomstående inkräktare. Immunsystemet består av miljarder individuella vita blodkroppar som cirkulerar i vår blodomlopp och rör sig i våra vävnader och patrullerar efter tecken på infektion eller vävnadsskada. Kroppens försvar består av många olika typer av vita blodkroppar som inkluderar lymfocyter, monocyter och granulocyter. Lymfocyter delas i sin tur ytterligare in i T-celler, B-celler och NK-celler.
Identifiering av varje celltyp är väsentlig för att förstå deras specifika roller och bedriva forskning inom området immunologi. T- och B-lymfocyter är två stora adaptiva immunceller i vår kropps försvarssystem. Den liknande storleken och formen på cellerna gör det dock svårt att särskilja dem. För närvarande görs särskiljning av olika celltyper genom att färga celler med fluorescerande antikroppar som binder till olika kluster av differentieringsreceptorer (CD) på cellytan.
Nu har ett team under ledning av professor Chang Young-Tae vid Center for Self-assembly and Complexity inom Institute for Basic Science i Pohang, Sydkorea, framgångsrikt utvecklat en liten molekylsond CDyB (som står för Compound of Designation gul för B-cell ) som kan åstadkomma särskiljning av levande B-celler från T-celler. CDyB upptäcktes med hjälp av en opartisk fluorescensbiblioteksscreening som kallas Diversity Oriented Fluorescence Library, eller DOFL. Genom att använda denna process kunde forskarna screena för tusentals olika molekyler för deras specificitet för en typ av immuncell framför en annan. När den applicerades på en blandning av T- och B-celler, visade sig denna nya sond ha hög selektivitet mot B-celler.
CDyB är en ny typ av sond som inte kräver CD-specifika antikroppar för att skilja olika celltyper. Det visade sig snarare kunna komma in i själva cellen och färga det endoplasmatiska retikulumet (ER) och Golgi-apparaten, som är framträdande organeller i cellerna som är ansvariga för att transportera material inuti cellerna. Detta tros vara möjligt tack vare molekylens förmåga att lätt passera genom cellmembran.
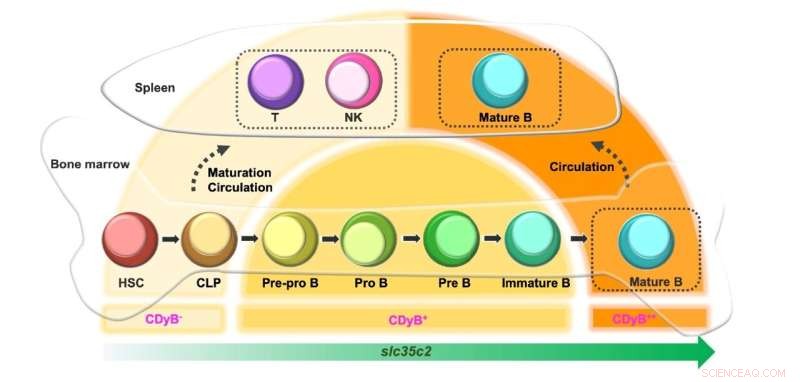
Schematisk över CDyB fluorescerande intensitet beroende på B-cellsutvecklingen. Kredit:Institutet för grundvetenskap
Efter att ha insett att CDyB är lokaliserat inom ER / Golgi-organellerna, spekulerade forskarna att mekanismen för B-cellselektivitet är baserad på gating. Med andra ord måste vissa transportörmolekyler vara ansvariga för upptaget och ackumuleringen av CDyB inuti organellerna i vissa celler, men inte de andra. Därför myntade de den nya termen, gating-oriented live-cell distinction (GOLD) för att beskriva denna nyupptäckta mekanism för att särskilja olika typer av celler.
Därefter försökte forskarna ta reda på varför CDyB bara färgar organellerna i B-cellerna, men inte T-cellerna. Forskarna undersökte vidare mekanismen för den nya sonden genom att använda ett SLC-CRISPR-baserat bibliotek, som är en plattform som erbjuder en stor chans för systematisk gating-målupplysning. Genom att använda SLC-CRISPRa och SLC-CRISPRi upptäckte forskarna att SLC35C2 var transportören specifik för CDyB, vilket gör att molekylen kan transporteras in i organellerna. Måltransportören validerades ytterligare genom genuttrycksanalysen. Forskarna utförde ytterligare knockout-experiment och visade att borttagning av transportören tog bort förmågan hos molekylen att internaliseras av ER/Golgi i målcellerna, vilket bevisade rollen av SlC35C2 för B-cellselektiviteten.
Intressant nog observerade forskarna att CDyB-signalen var starkare i mogna B-celler än i omogna B-celler. Detta beror med största sannolikhet på att uttrycket av SLC35C ökar i enlighet med B-cellernas mognad. Progenitorcellerna såsom hematopoetiska stamceller (HSC) och vanlig lymfoid stamceller (CLP) uttrycker en låg nivå av SLC35C2 och färgas således minimalt av CDyB. När de differentierar till T- och NK-celler förblir uttrycket av SLC35C2 lågt, vilket ger svag CDyB-fluorescens. Om cellerna differentierar till B-cellslinjer ökar SLC35C2-uttrycket under mognadsvägen. De delvis differentierade B-cellsprogenitorerna (Pre-Pro B, Pro B, Pre B) uppvisar måttlig CDyB-fluorescens, och de fullt mogna B-cellerna uppvisar den högsta nivån av CDyB-fluorescens.
Noterbart är att professor Changs team tidigare låste upp en annan B-cellselektiv sond som heter CDgB (Compound of Designation green for B Cells) förra året. Till skillnad från CDyB skiljer den B-celler över T-celler med hjälp av mekanismen Lipid-Oriented Live-cell Distinction (LOLD). LOLD utnyttjar den lilla skillnaden i membrankomponenter, såsom kolkedjelängd och kolesterolinnehåll, och flexibiliteten för cellsärskiljning. Medan CDyB visade starkare fluorescens i mogna B-celler, visade CDgB den ljusaste färgningen i omogna B-celler på grund av deras mjukare membranstruktur. Man hoppas att användningen av båda dessa molekyler med mekanismer tillsammans kan vara ett effektivt sätt att särskilja olika celltyper i blodkroppar.
Denna studie berikar den molekylära sondens verktygslådan och molekylär förståelse för särskiljning av levande B-celler och öppnar möjligheten för multidimensionell cellanalys baserad på den ortogonala mekanismen med ny insikt. Detta arbete publicerades i Angewandte Chemie International Edition den 5 juli. + Utforska vidare