Kredit:CC0 Public Domain
En ny peptid som utvecklats vid universiteten i Bayreuth och Bristol är utomordentligt lämpad för riktad transport av molekyler—till exempel av aktiva substanser och färgämnen—in i däggdjursceller. Peptiden kännetecknas av en dubbel funktion:Den kan komma in i cellen utifrån och interagera där med en partnerpeptid. Partnerpeptiden ska tidigare ha placerats inne i cellen exakt där de transporterade molekylerna ska verka. Transportsystemet presenteras i tidskriften Nature Chemical Biology exemplifierar den lovande potentialen hos en de novo-design av peptider och proteiner.
Under de senaste åren har biomedicin och farmakologi utvecklat ett stort antal aktiva substanser som kan trigga, förstärka eller hämma processer i däggdjursceller. Att transportera dessa ämnen exakt dit de behövs är dock fortfarande en utmaning i många fall. Situationen är liknande när det gäller att färgmarkera vissa strukturer inuti celler för forskning eller diagnostiska ändamål. Det är sant att däggdjursceller har förmågan att inkorporera främmande ämnen genom endocytos. Men detta garanterar inte på något sätt transport till den önskade handlingsplatsen. En ny forskningsmetod som Bayreuth-biokemisten Prof. Dr. Birte Höcker följer med sin forskargrupp är den rationella designen av peptider. Dessa ska kunna tränga in i cellens inre utifrån och ta med sig vidhäftade aktiva substanser eller färgämnesmolekyler. Peptider som är lämpliga för detta ändamål är ganska små eftersom de vanligtvis består av mindre än 30 aminosyror.
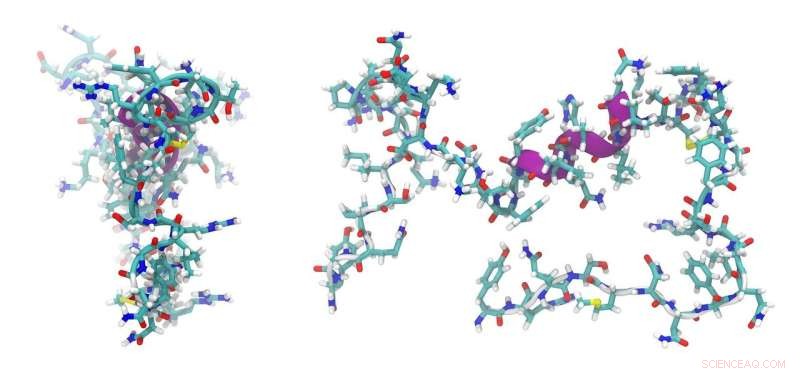
Hittills har dock problemet varit att sådana peptider – just på grund av sin enkelhet och ringa storlek – inte erbjuder många möjliga tillämpningar. Detta beror på att det bara finns ett fåtal områden i de olika strukturerna i cellens inre där de kan docka och leverera de molekyler de transporterar. Denna nackdel har övervunnits av peptiden som utvecklats i Bayreuth och Bristol. Det är en basisk peptid med ett högt innehåll av argininaminosyror, och den har två komponenter som är viktiga för dess funktionalitet. Den ena tillåter peptiden att komma in i cellens inre, och den andra kan interagera med en sur partnerpeptid. Denna partnerpeptid är sådan att den kan placeras på väldigt olika platser inuti cellen med hjälp av etablerade biokemiska metoder. När väl proteiner, större molekylära komplex eller organeller har märkts med partnerpeptiden, kan de riktas mot den grundläggande peptiden som har kommit in i cellen. Som en nyckel i ett lås låser sig den grundläggande peptiden på den sura peptiden. Den riktade placeringen av den sura partnerpeptiden uppnås genom att den kopplas till molekyler som i sin tur förs in i cellens DNA genom transfektion.
Det anglo-tyska forskarteamet designade de två tidigare okända de novo-peptiderna med hjälp av metoder för datorstödd proteindesign. Grunden för detta arbete var peptider med en spiralstruktur, som beskrevs i en strukturdatabas. Peptiderna som designats på datorn syntetiserades sedan i laboratoriet. Här användes biofysiska metoder och röntgenkristallografi för att identifiera peptidernas verkliga egenskaper och beteende. Experiment med E. coli-bakterier och eukaryota celler visade att det nya peptidsystemet till och med är lämpligt för att transportera andra peptider och proteiner.
"Our investigations exemplify how the computational design of peptides and proteins, their subsequent synthesis and characterization in the laboratory, as well as testing in living cells can intertwine when innovative solutions for biochemical or biomedical questions are being sought," says Prof. Dr. Birte Höcker, head of the Protein Design Group at the University of Bayreuth and corresponding author of the new study.
"The new peptide system makes it clear that de novo design is a promising research approach in the search for methods that enable drug or dye molecules to be introduced into mammalian cells in a targeted and gentle manner," adds Dr. Guto Rhys, postdoc at the Protein Design research group and one of the three first authors. + Utforska vidare